
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
分析 A.△H-T△S<0的反应可自发进行;
B.热化学方程式中△H的值与反应的书写有关;
C.化学反应的实质为旧键断裂、新键生成,则化学反应中一定伴随能量变化;
D.增大反应物浓度是通过增大活化分子数目.
解答 解:A.△H-T△S<0的反应可自发进行,则熵变小于零而焓变大于零的反应,△H-T△S>0,反应不能自发进行,故A正确;
B.热化学方程式中△H的值与反应的书写有关,与反应物的用量无关,故B错误;
C.化学反应的实质为旧键断裂、新键生成,旧键断裂吸收能量,新键形成释放能量,则化学反应中一定伴随能量变化,反应前后物质的总能量不相等,故C错误;
D.其他条件不变,增大反应物浓度是通过增大活化分子数目,使化学反应速率加快,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应进行方向的判断、化学反应中能量变化、影响速率的因素等为解答的关键,侧重分析与应用能力的考查,注意热化学反应中焓变的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 待测食醋的体积初读数/mL | 0.02 | 0.03 | 0.00 |
| 待测食醋的体积终读数/mL | 25.01 | 25.04 | 25.02 |
| 氢氧化钠标准液的体积初读数/mL | 0.01 | 0.03 | 0.04 |
| 氢氧化钠标准液的体积终读数/mL | 12.52 | 12.55 | 12.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
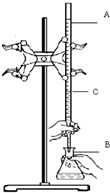 在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:
在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氧气中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 当He、H2、O2三种气体的温度和密度都相同时,它们的压强大小是p(O2)>p(He)>p(H2) | |
| D. | 等物质的量的干冰和葡萄糖(分子式为C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2 | |
| B. | 欲配制1.00 L1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 22.4LN2和H2的混合气体中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,得到8NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com