
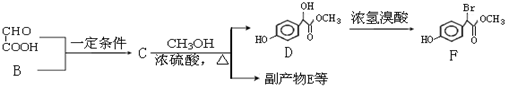
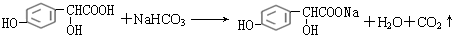 .
. .
.分析 C与甲醇反应生成D,由D的结构可知应是发生酯化反应,可推知C为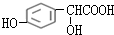 ,B与OHC-COOH反应生成C,应是发生加成反应,可知B为
,B与OHC-COOH反应生成C,应是发生加成反应,可知B为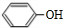 .副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为
.副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为 .对比D、F的结构可知,D中-OH被-Br取代生成F.
.对比D、F的结构可知,D中-OH被-Br取代生成F.
解答 解:C与甲醇反应生成D,由D的结构可知应是发生酯化反应,可推知C为 ,B与OHC-COOH反应生成C,应是发生加成反应,可知B为
,B与OHC-COOH反应生成C,应是发生加成反应,可知B为 .副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为
.副产物E是由2分子C生成的含有3个六元环的化合物,其结构简式为 .对比D、F的结构可知,D中-OH被-Br取代生成F.
.对比D、F的结构可知,D中-OH被-Br取代生成F.
(1)有机物B为 ,名称是苯酚,
,名称是苯酚,
故答案为:苯酚;
(2)A与B反应生成C的反应类型为加成反应,
故答案为:加成反应;
(3)有机物C与足量的碳酸氢钠溶液反应的化学方程式: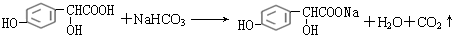 ,
,
故答案为: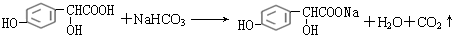 ;
;
(4)E是由2分子C生成的含有3个六元环的化合物,其结构简式为: ,
,
故答案为: ;
;
(5)符合下列条件的D的所有同分异构体:
①苯环上只有2个处于对位的取代基;②遇氯化铁溶液显紫色,说明含有酚羟基,③分子中含有一个羧基,另外侧链为:-CH(OH)CH2COOH、-CH2CH(OH)COOH、-C(OH)(CH3)COOH、-CH(CH2OH)COOH、-OCH2CH2COOH、-CH2OCH2COOH、-CH2CH2OCOOH、-OCH(CH3)COOH、-CH(CH3)OCOOH、-CH(OCH3)COOH,符合条件的共有10种,
故答案为:10.
点评 本题考查有机物的推断与合成、有机反应方程式书写、限制条件同分异构体书写等,熟练掌握官能团的性质与转化,(5)中同分异构体的书写为易错点、难点.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②④③① | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、天然气等燃烧产生大量二氧化碳 | |
| B. | 大量燃烧含硫量高的煤产生二氧化硫 | |
| C. | 森林遭到乱砍烂伐,破坏了生态环境 | |
| D. | 各种机动车排放的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4 的质量为98 g•mol-1 | |
| B. | H2SO4的摩尔质量为98 g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
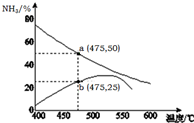 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com