
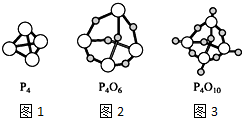
 如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )
如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )| A. | P4O6中的磷原子采用sp2方式杂化 | |
| B. | 三氧化二磷、五氧化二磷这两个名称都表示分子的实际组成 | |
| C. | P4、P4O6和P4O10分子中同一P原子上两个化学键之间的夹角都是60° | |
| D. | P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体 |
分析 A.根据价层电子对互斥理论确定原子杂化类型,价层电子对=σ键个数+孤电子对个数;
B.三氧化二磷、五氧化二磷只表示原子个数比,应为六氧化四磷、十氧化四磷;
C.P4同一P原子上两个化学键之间的夹角是60°,P4O6和P4O10分子化学键之间的夹角近似等于109°28′;
D.P4为正四面体结构,两个磷之间插入一个氧原子,得到P4O6.
解答 解:A.P4O6中的磷原子杂化轨道数=σ键数+孤对电子对数=3+1=4,所以采取sp3杂化;故A错误;
B.三氧化二磷、五氧化二磷只表示原子个数比,这两个名称都未表示分子的实际组成,应为P4O6、P4O10,故B错误;
C.P4为正四面体结构,四个磷处在正四面体的顶点,同一P原子上两个化学键之间的夹角是60°,两个磷之间插入一个氧原子,得到P4O6,P4O6四个磷再插入一个氧原子得到P4O10,P4O6和P4O10分子中同一P原子上化学键之间的夹角近似等于109°28′,故C错误;
D.P4为正四面体结构,四个磷处在正四面体的顶点,两个磷之间插入一个氧原子,得到P4O6,在P4O6分子中,4个P原子构成正四面体,6个O原子构成正八面体,故D正确;
故选D.
点评 本题考查P4、P4O6和P4O10的结构,为高频考点,把握空间结构为解答的关键,注意选项C为解答的易错点,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| t/min | 1 | 4 | 8 | 11 |
| N(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 反应前4min的平均速率v(C02)=0.45 mol/(L min) | |
| B. | 该温度下,该反应的平衡常数为0.5 | |
| C. | 其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大 | |
| D. | 达到平衡时,H2的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
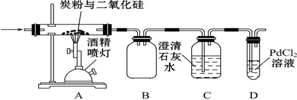
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为平面三角形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | SiF4和SO3的中心原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
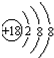 ;
;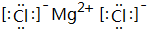 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com