
 +H2O.
+H2O. 分析 CH2═CHCH3与溴在高温下发生反应生成A为CH2═CHCH2Br,A发生信息中第一步反应生成B,则B为CH2═CHCH2MgBr,B与HCHO发生信息中反应生成C,C的分子式为C4H8O,C与溴发生加成反应生成D,则C为CH2═CHCH2CH2OH,由E的分子式与2,3-二氢呋喃结构可知,E中脱去1分子HBr生成2,3-二氢呋喃,则D中羟基提供1个H原子、4号碳原子提供1个Br原子脱去1分子HBr形成环状物质E,则E的结构简式为 ,E发生消去反应生成2,3一二氢呋喃,据此解答.
,E发生消去反应生成2,3一二氢呋喃,据此解答.
解答 解:CH2═CHCH3与溴在高温下发生反应生成A为CH2═CHCH2Br,A发生信息中第一步反应生成B,则B为CH2═CHCH2MgBr,B与HCHO发生信息中反应生成C,C的分子式为C4H8O,C与溴发生加成反应生成D,则C为CH2═CHCH2CH2OH,由E的分子式与2,3-二氢呋喃结构可知,E中脱去1分子HBr生成2,3-二氢呋喃,则D中羟基提供1个H原子、4号碳原子提供1个Br原子脱去1分子HBr形成环状物质E,则E的结构简式为 ,E发生消去反应生成2,3一二氢呋喃.
,E发生消去反应生成2,3一二氢呋喃.
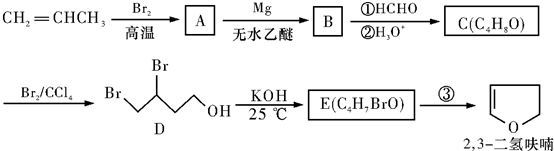
(1)呋喃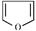 、2,3二氢呋喃
、2,3二氢呋喃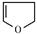 、四氢呋喃
、四氢呋喃 分子的结构不相似,分子中的C原子数相同,H原子数不同,所以在物质分类上不是同系物,故答案为:否;
分子的结构不相似,分子中的C原子数相同,H原子数不同,所以在物质分类上不是同系物,故答案为:否;
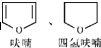
(2)用系统命名法命名化合物D(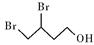 )的名称为:3,4-二溴-1-丁醇,故答案为:3,4-二溴-1-丁醇;
)的名称为:3,4-二溴-1-丁醇,故答案为:3,4-二溴-1-丁醇;
(3)反应③发生卤代烃的消去反应,反应的条件为:氢氧化钠醇溶液、加热,故答案为:氢氧化钠醇溶液、加热;
(4)由于在2,3二氢呋喃分子中含有C=C双键,能跟溴水会溴的CCl4溶液发生加成反应而使溶液褪色,或与高锰酸钾溶液、重铬酸钾溶液作用使溶液褪色.而四氢呋喃中无C=C双键,不能发生上述反应.因此若使溴水、溴的四氯化碳溶液、酸性高锰酸钾溶液、重铬酸钾溶液作用使溶液褪色,则含有2,3二氢呋喃,否则不含有2,3二氢呋喃,
故答案为:用溴的四氯化碳溶液(或溴水)或高锰酸钾溶液、重铬酸钾溶液检验,不褪色表明已完全转化;
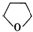
(5)由化合物C4H10O2在少量浓硫酸存在下制得四氢呋喃的化学方程式为:HO-CH2CH2CH2CH2-OH$→_{△}^{浓硫酸}$ +H2O,故答案为:HO-CH2CH2CH2CH2-OH$→_{△}^{浓硫酸}$
+H2O,故答案为:HO-CH2CH2CH2CH2-OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.
点评 本题考查有机物的推断与合成,需要学生对给予想信息进行利用,较好的考查学生的自学能力,注意根据转化关系中有机物的结构进行推断,较全面考查有机物的性质及对知识的迁移运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
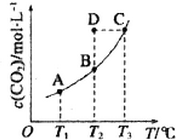 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 | |
| B. | 在T2时,若反应处于状态D,则一定有υ正>υ逆 | |
| C. | 平衡状态A 与C 相-比,平衡状态A 的c(CO)大 | |
| D. | 若T1、T2 时的平衡常数分别为K1、K2则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NaHC2O4溶液与0.1mol•L-1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液与10mL 0.1mol•L-1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液与0.1mol•L-1HNO3等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
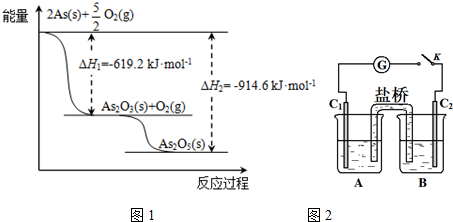
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
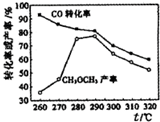 研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )
研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )| A. | △H<0 | |
| B. | 该反应伴随有副反应的发生 | |
| C. | 制备二甲醚的适宜温度为280~290℃ | |
| D. | 加入催化剂可以提高CH3 OCH3的产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com