
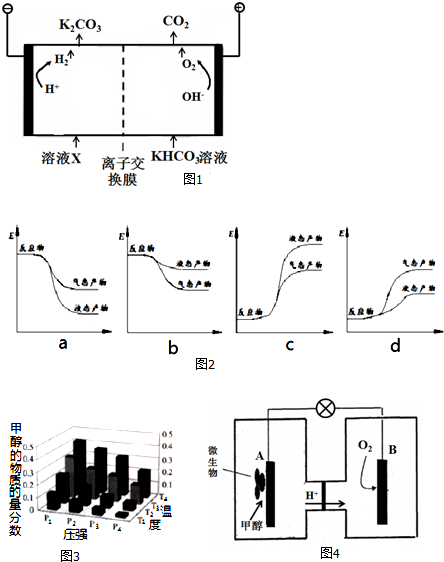
分析 (1)①阳极上氢氧根离子放电生成氧气;
②碳酸氢根离子程度电离平衡、氢氧根离子和碳酸氢根离子反应生成碳酸根离子;
(2)①根据盖斯定律计算;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小;
(3)A.增大压强,平衡正向移动,结合图象判断甲醇的物质的量分数变化情况判断压强大小;
B.平衡常数只与温度有关;
C.温度升高,平衡向着吸热方向进行,反之向着放热方向进行;
D.根据转化率等于变化量和初始量的比值进行计算即可;
(4)B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变;A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成.
解答 解:(1)①阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
②HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移;
(2)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
将方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图象是a,
故答案为:a;
(3)A.增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,故A正确;
B.平衡常数只受温度的影响,温度不变,平衡常数不变,故B错误;
C.CO(g)+2H2(g)?CH3OH(g),△H<0,此反应为放热反应,故升高温度,甲醇的含量减小,故T1>T2>T3>T4,故C正确;
D.T4、P4时,甲醇的物质的量分数是0.2,设消耗氢气的物质的量是3x,
3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)
初始量:5 2 0 0
变化量:3x x x x
平衡量:5-3x 2-x x x
$\frac{x}{5-3x+2-x+2x}$=0.2,解得x=1,所以H2的平衡转化率为$\frac{3}{5}$×100%=60%,故D正确;
故答案为:ACD;
(4)B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变,故溶液pH不变;A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成,电极反应式为:CH3OH+H2O-6e-═6H++CO2↑,
故答案为:不变;CH3OH+H2O-6e-═6H++CO2↑.
点评 本题考查较综合,涉及原电池原理、盖斯定律、电解原理等知识点,根据燃料电池中正负极发生的电极反应、盖斯定律的内涵、电解池中离子放电顺序来分析解答,难点是电极反应式的书写,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
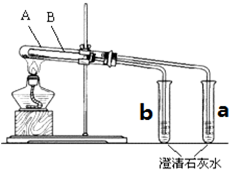 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
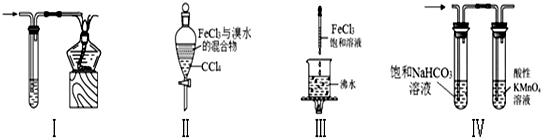
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气凝结为液态的水 | B. | 氨气和氯化氢反应生成氯化铵晶体 | ||
| C. | 碳酸氢铵在常温情况下分解 | D. | CO点燃时生成CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com