
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
分析 A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液;
B.水杨酸为邻羟基苯甲酸,含有羧基、酚羟基,羧基能与碳酸氢钠反应;
C.纳米粒子是指粒度在1-100nm之间的粒子,与胶体相同,胶体的聚沉属于物理变化;
D.二氧化硫、二氧化氮是形成酸雨的主要物质.
解答 解:A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.水杨酸为邻羟基苯甲酸,含有羧基、酚羟基,羧基能与碳酸氢钠反应生成二氧化碳,服用阿司匹林出现水杨酸反应时,可以用NaHCO3溶液解毒,故B正确;
C.石油裂解、煤的干馏、玉米制醇、均有新物质生成,属于化学变化,但是纳米银粒子的聚集属于小颗粒的胶体离子变成大颗粒聚成下来,没有新物质生成,蛋白质的变性也可能属于物理变化,故C错误;
D.采用燃料脱硫技术可以减少二氧化硫的产生,从而防止出现酸雨,NOx的催化转化生成无污染的氮气也是减少酸雨的有效措施,故D正确.
故选C.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
 HClO+H++Cl-.
HClO+H++Cl-.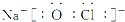 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液 的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象, 再将水加热 | 开始无现象,加热后有气体产生 |
| C、将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D、将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.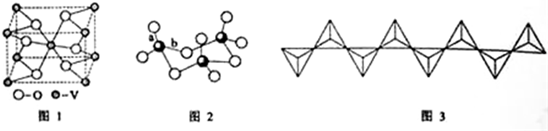
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
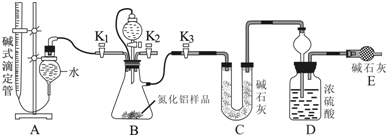
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com