
| A、向氯水中通入SO2:SO2+Cl2+H2O═SO42-+2Cl-+2H+ |
| B、将铝片打磨后置于NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| C、向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+═Fe3++3H2O |
| D、向NaAlO2溶液中通入足量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |


科目:高中化学 来源: 题型:
| A、强电解质在溶液中完全电离成阴、阳离子 |
| B、强电解质溶液导电能力不一定比弱电解质溶液导电能力强 |
| C、同一弱电解质同浓度的溶液,温度不同时,导电能力不同 |
| D、强电解质易溶于水,弱电解质一定难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、置换反应、氧化还原反应、化学反应 |
| B、H2O、电解质、化合物 |
| C、胶体、溶液、混合物 |
| D、Fe3O4、金属氧化物、氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| cMg2+ |
| cCu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
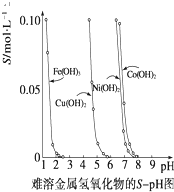 根据题目提供的溶度积数据进行计算并回答下列问题:
根据题目提供的溶度积数据进行计算并回答下列问题:| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、SO42-、NH4+、Na+ |
| B、Cl-、SCN-、NO3-、Cu2+ |
| C、Br-、I-、Mg2+、Na+ |
| D、H+、Cl-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
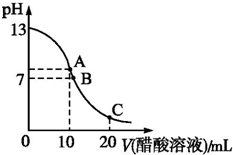 25℃时,在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
25℃时,在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )| A、在A点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、A、B、C三点中,B点水的电离程度最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com