
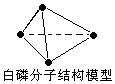
| A. | 31g白磷分子中含有P-P键个数为1.5×6.02×1023 | |
| B. | 48g O2和48g O3所含分子数相等 | |
| C. | 1mol/L氨水中,NH3•H2O的分子数为6.02×1023 | |
| D. | 20g重水(D2O)中含有的中子数为8×6.02×1023 |
分析 A、质量换算物质的量,结合白磷分子结构计算磷磷键数目;
B、根据分子数目N=$\frac{m}{M}$NA来计算;
C、一水合氨是弱电解质存在电离平衡,溶液体积不知不能计算微粒数;
D、质量换算物质的量,结合分子式和质量数=中子数+质子数计算得到.
解答 解:A、31g 白磷分子(P4)物质的量=$\frac{31g}{124g/mol}$=0.25mol,分子中含有P-P键个数=6×0.25mol×NA=1.5NA=1.5×6.02×1023,故A正确;
B、48g氧气中的分子数目N=$\frac{m}{M}$NA=$\frac{48g}{32g/mol}$NA=1.5NA,48g臭氧中的分子数目N=$\frac{m}{M}$NA=$\frac{48g}{48g/mol}$NA=NA,故混合气体中的分子数为2.5NA个,故B错误;
C、1mol/L氨水中,一水合氨是弱电解质存在电离平衡,溶液体积不知不能计算微粒数,故C错误;
D、20g 重水(D2O)物质的量=$\frac{20g}{20g/mol}$=1mol,分子中含有的中子数=1mol×[2×(2-1)+16-8]×NA=10 NA=10×6.02×1023,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意物质结构的分析判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热大约在3540 KJ/mol左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Cl-、Na+ | B. | MnO4-、Ca2+、NO3-、Cl- | ||
| C. | HSO3-、HCO3-、NO3-、SO32- | D. | Na+、Ca2+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2是酸性氧化物 | |
| C. | X与Z的氢化物中沸点较高的是Z | |
| D. | WX2中只含有极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com