
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1 083℃ | 660℃ | 1 535℃ |
| 沸点 | 883℃ | 2 595℃ | 2 200℃ | 3 000℃ |
其中不能形成合金的是 ( )
A.Cu和Na B.Fe与Cu
C.Fe与Al D.Al与Na
科目:高中化学 来源: 题型:
下列与化学概念有关的说法正确的是
A.化合反应均是氧化还原反应 B.金属氧化物均为碱性氧化物
C.催化剂能改变可逆反应达到平衡的时间 D.石油是混合物,其分馏产品汽油为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
A.图中A点对应溶液的pH:a=1
B.生成沉淀的最大质量m=2.33g
C.原混合液中c(HCl)=0.2mol·L-1
D.当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:
c(Cl-)>c(Ba2+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
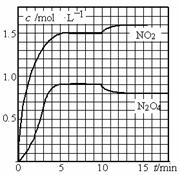 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃, 10min后升高并维持容器的温度为T2℃。下列说法正确的是( )
A.前5min反应的平均速率v(N2O4)=0.18mol·L-1·s-1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Al、Fe、Cu三种金属,下列说法正确的是( )
A.三者的单质均为银白色固体
B.三者都能与盐酸、稀硫酸反应
C.AlCl3、FeCl3、CuCl2均可作净水剂
D.制备Al用电解法,制备Fe、Cu可用还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组,收集了一种合金进行研究(已知Cu的焰色反应为绿色)。
(1)外观暗灰色,表面光滑;
(2)在酒精灯上灼烧,火焰呈绿色;合金片熔化,但不滴落;
(3)取刮去表皮的金属10.0 g,放入足量稀硫酸溶液中,收集到标准状况下的H29.96 L;
(4)另取刮去表皮的金属10.0 g,放入足量NaOH溶液中,也收集到标准状况下的H29.96 L。
试据此判断,合金中一定含有的元素是 (写元素符号);下列元素可能含有的是 (填选项编号)。
a.Ag b.Mg c.Mn d.Fe
如果该合金中,只含两种元素,它们的质量比是______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在AlCl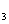 和FeCl
和FeCl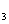 混合溶液中,先加入过量的KI溶液,再加入足量的Na
混合溶液中,先加入过量的KI溶液,再加入足量的Na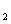 S溶液,所得 到的沉淀物是
S溶液,所得 到的沉淀物是
A.Fe(OH)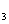 、Al(OH)
、Al(OH)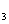 B.Al(OH)
B.Al(OH)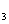 、I
、I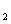
C.Fe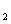 S
S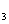 、I
、I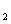 D.FeS、S、Al(OH)
D.FeS、S、Al(OH)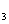
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
A.Na2O2和NaHCO3 B.NaHCO3和Na2CO3
C.NaOH和Na2CO3 D.只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________________________________________________________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com