
| A. | 水是弱电解质 | B. | 可燃冰是可以燃烧的水 | ||
| C. | 氢氧两种元素只能组成水 | D. | 0℃时冰的密度比液态水的密度大 |
分析 A.水能够部分电离出氢离子和氢氧根离子,存在电离平衡;
B.可燃冰为甲烷和水形成的一种化合物;
C.氢氧两种元素还可以组成双氧水;
D.液体水变成冰,体积变大,密度变小.
解答 解:A.水为极弱的电解质,能够部分电离出氢离子和氢氧根离子,故A正确;
B.可燃冰为甲烷和水形成的一种特殊的化合物,并不是可燃烧的水,故B错误;
C.氢氧两种元素可以组成水、双氧水,故C错误;
D.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故D错误;
故选A.
点评 本题考查了水的电离、水的组成结构及性质,题目难度不大,注意掌握水的电离,明确可燃冰的组成及性质,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
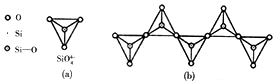
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

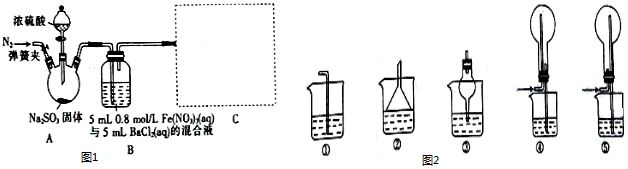
| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 | |
| C. | 图3所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| D. | 图4所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com