
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
分析 A.二者反应后溶质为等浓度的硫酸铵和硫酸钠,根据混合液中的物料守恒进行判断;
B.根据碳酸和碳酸氢根离子的电离平衡常数进行分析;
C.根据混合液中的物料守恒和电荷守恒进行判断;
D.氯化银存在溶解平衡,溶液中氯离子浓度越大,则银离子浓度越小.
解答 解:A.向10mL 0.1mol•L-1NH4HSO4溶液中滴加10mL 0.1mol•L-1NaOH溶液,二者反应后溶质为等浓度的硫酸铵和硫酸钠,根据物料守恒可得:c(SO42-)═c(NH4+)+c(NH3•H2O),故A错误;
B.根据碳酸的电离平衡常数可得:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$=$\frac{K({H}_{2}C{O}_{3})}{c({H}^{+})}$,根据碳酸氢根离子的电离平衡常数可得:$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$=$\frac{K(HC{{O}_{3}}^{-})}{c({H}^{+})}$,混合液中氢离子浓度相同,而碳酸的电离平衡常数大于碳酸氢根离子,所以:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$>$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$,故B错误;
C.物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:根据物料守恒可得:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S),根据电荷守恒可得:2c(H+)+c(Na+)=2c(S2-)+c(HS-)+c(OH-),二者结合可得:2c(OH-)-2c(H+)═3 c(H2S)+c(HS-)-c(S2-),故C正确;
D.将足量的AgCl分别放入:①5 ml水②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中,氯离子浓度大小为:②>③>①,氯离子浓度越大,银离子浓度越小,则饱和溶液中c(Ag+)大小为:①>③>②,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及电离平衡常数的应用、难溶物溶解平衡及其应用、离子浓度大小比较等知识,注意明确物料守恒、电荷守恒及盐的水解原理在判断离子浓度大小中的应用方法,B为易错点,需要根据电离平衡常数进行判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{94}^{224}$Pu位于周期表中第六周期 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
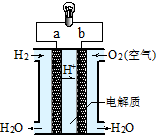
| A. | a极是正极 | B. | 电池总反应式为:2H2+O2=2H2O | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
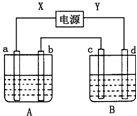 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

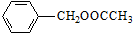 是其中的一种,该有机物能发生的反应为a(填字母).
是其中的一种,该有机物能发生的反应为a(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com