

分析 硼砂Na2[B4O5(OH)4]•8H2O易溶于水,可少量水解生成等物质的量的H3BO3(硼酸)和NaBO2(硼酸钠),硼砂水解生成的NaBO2能和NaOH发生复分解反应生成硫酸钠和硼酸,然后加入ZnO得到2ZnO•3B2O5,然后冷却结晶、洗涤、干燥、研磨得到2ZnO•3B2O5•3.5H2O,
(1)根据化合价代数和为0计算;H3BO3是一元弱酸;
(2)步骤②中硫酸和硼酸钠发生复分解反应;
(3)硼酸锌(2ZnO•3B2O5•3.5H2O)能在高温下脱水;
(4)步骤④若在实验室进行,需要的玻璃仪器除烧杯外,还有漏斗和玻璃棒;
(5)晶体吸附的是硫酸根离子,硫酸根离子用盐酸酸化的氯化钡溶液检验;
(6)在873K下,利用氢化锂、单质硼及氢气可制取LiBH4,根据反应物、生成物和反应条件书写化学方程式.
解答 解:(1)硼砂Na2[B4O5(OH)4]•8H2O中钠元素+1价,氧元素-2价,氢元素+1价,化合价代数和为0,则B元素的化合价为+3;H3BO3是一元弱酸;
故答案为:+3;弱酸;
(2)步骤②中硫酸和硼酸钠发生复分解反应生成硫酸钠和硼酸,反应方程式为2NaBO2+H2SO4+2H2O=Na2SO4+2H3BO3;
故答案为:2NaBO2+H2SO4+2H2O=Na2SO4+2H3BO3;
(3)硼酸锌(2ZnO•3B2O5•3.5H2O)能在高温下脱水,所以不能在高温下制取;
故答案为:不能;高温下硼酸锌会脱水;
(4)步骤④若在实验室进行,需要的玻璃仪器除烧杯外,还有漏斗和玻璃棒,漏斗进行过滤、玻璃棒引流;
故答案为:漏斗、玻璃棒;
(5)晶体吸附的是硫酸根离子,硫酸根离子用盐酸酸化的氯化钡溶液检验,其操作方法为:取最后洗涤液中的上层液体,向溶液中加入盐酸酸化的氯化钡溶液,如果产生白色沉淀就说明没有洗涤干净,否则已经洗涤干净;
故答案为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗净;
(6)在873K下,利用氢化锂、单质硼及氢气可制取LiBH4,根据反应物、生成物和反应条件书写化学方程式,反应方程式为2LiH+2B+3H2$\frac{\underline{\;873K\;}}{\;}$2IiBH4;
故答案为:2LiH+2B+3H2$\frac{\underline{\;873K\;}}{\;}$2IiBH4.
点评 本题考查了物质的制备,为高频考点,涉及基本操作、离子检验等知识点,明确基本操作方法、物质或离子性质等知识点是解本题关键,注意硫酸根离子检验方法,易错点是化学用语的正确运用,需要学生加强练习.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
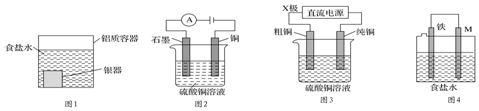
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )| A. | 若升高温度,X的体积分数增大,则正反应的△H>0 | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.001mol/(L•s) | |
| D. | 若图纵坐标是正反应速率,则反应应该在绝热条件下进行,图象最高点为平衡点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com