
A、氟离子的结构示意图: |
B、CH4的比例模型: |
C、羧基的电子式: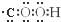 |
| D、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
 ,故A错误;
,故A错误; ,故B正确;
,故B正确; ,故C错误;
,故C错误;

科目:高中化学 来源: 题型:
| A、Ba2+、Na+、NO3-、Br- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、AlO2-、SO42- |
| D、NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 装置 | 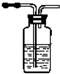 | 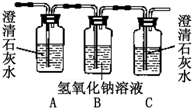 | 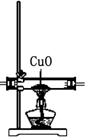 | 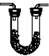 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- CH3COO- |
| D、K+ Ca2+ CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
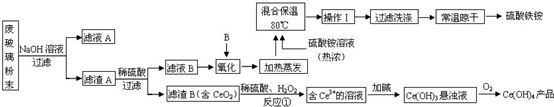

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酯化反应、硝化反应以及酯的水解均属于取代反应类型 |
| B、乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 |
| C、可用氢氧化钠溶液除去乙酸乙酯中混有乙酸和乙醇 |
| D、蛋白质、淀粉、油脂均属于天然高分子化合物,均能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com