
| A. | 阴极上产生红色物质 | B. | 阴极附近溶液呈红色 | ||
| C. | 阴极上产生氯气 | D. | 阳极上产生氢气 |
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.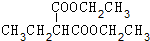 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | CH≡CH | CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
| B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
| C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .由18O、16O、H、D原子组成的H2O2分子共有9种.
.由18O、16O、H、D原子组成的H2O2分子共有9种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 实验室用排饱和食盐水法收集氯气 | ||
| C. | 打开汽水瓶盖,即有大量氕泡逸出 | D. | 温度升高,纯水中的H+浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com