
【题目】将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1molL﹣1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
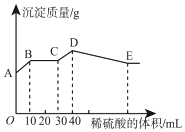
A.B点所表示的沉淀是:Al(OH)3、BaSO4
B.B﹣C段所发生反应的离子方程式是:H++OH﹣→H2O
C.A﹣B段发生反应的离子方程式:Ba2++SO42﹣→BaSO4↓
D.拐点E的横坐标为80mL
【答案】B
【解析】
根据图象可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子。
A.根据分析可知,B点沉淀为硫酸钡沉淀,故A错误;
B.BC段所发生反应的离子方程式为:H++OH﹣→H2O,故B正确;
C.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,故C错误;
D.CD段发生偏铝酸根离子与酸的反应,生成氢氧化铝沉淀消耗了10mL 1mol/L的稀硫酸,则稀硫酸的物质的量为:1mol/L×0.01L=0.01mol,消耗了0.02mol氢离子,根据反应AlO2﹣+H++H2O=Al(OH)3↓可知了生成0.02mol氢氧化铝沉淀;DE段氢氧化铝与氢离子反应,溶解0.02mol氢氧化铝需要消耗0.06mol氢离子,消耗硫酸的物质的量为0.03mol,消耗硫酸的体积为:![]() =0.03L=30mL,则拐点E的横坐标为:40mL+30mL=70mL,故D错误;
=0.03L=30mL,则拐点E的横坐标为:40mL+30mL=70mL,故D错误;
故选:B。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2)![]() 和
和![]() 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:

①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________。
②试解释酸性HClO3>HBrO3>HIO3的原因_________。
(4)![]() 的熔点为1040℃;
的熔点为1040℃;![]() 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
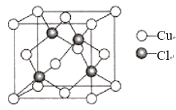
①Cu+的配位数为_____。
②氯化亚铜的密度为____![]() (用含NA的计算式表示)。
(用含NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3和NaHCO3的混合溶液,取该溶液50.00mL加水稀释到1L。
(1)从稀释后溶液中取出20.00mL.测量溶液体积的仪器事先进行洗涤的洗涤液依次为:自来水、_____、_____,对溶液体积读数的方法是读出_____对应的刻度值。
(2)稀释后溶液用标准盐酸(0.2000mol/L)进行滴定:
①取20.00mL溶液(酚酞做指示剂)消耗标准盐酸12.00mL。
②取10.00mL(甲基橙做指示剂)消耗标准盐酸15.00mL。
判断①滴定终点的现象是_____。则此次测定原样品溶液中碳酸氢钠的浓度_____。
(3)重复上述(2)滴定操作1﹣2次的目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.4v(NH3)=6v(H2O)D.4v(O2)= 5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com