
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- | |
| C. | 氯化铵的水解:NH4++H2O?NH4OH+H+ | |
| D. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
分析 A.弱电解质,存在电离平衡;
B.为强电解质,完全电离;
C.水解生成一水合氨和氢离子;
D.难溶电解质,存在溶解平衡.
解答 解:A.醋酸为弱酸,且电离方程式为CH3COOH?CH3COO-+H+,故A正确;
B.碳酸氢钠在水溶液中的电离方程式为NaHCO3=Na++HCO3-,故B错误;
C.氯化铵的水解离子反应为NH4++H2O?NH3.H2O+H+,故C错误;
D.碳酸钙的溶解平衡为CaCO3(s)?Ca2+(aq)+CO32-(aq),故D正确;
故选BC.
点评 本题考查离子反应的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解、电离的离子反应及分析与应用能力的考查,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
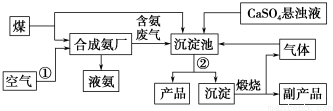
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
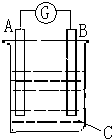 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b=a+1 | |
| B. | 某溶液由水电离的c(OH-)=1.0x10-13mol/L,则此溶液一定显酸性 | |
| C. | 将pH=4的醋酸稀释1000倍,溶液的pH=7 | |
| D. | pH=13的强碱溶液和pH=2的强酸溶液混合,若所得溶液的pH=7,则强碱与强酸的体积比是1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
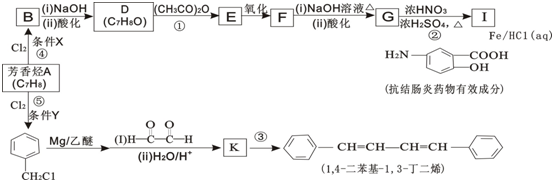
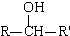 (R、R′表示烃基)
(R、R′表示烃基)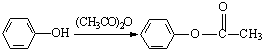
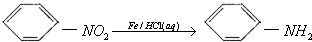
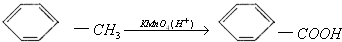
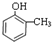
 .
.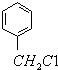 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.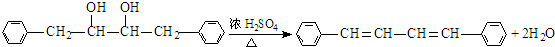 .
.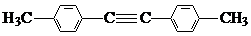
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com