
氢一氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:![]() +2OH-—2e-=2
+2OH-—2e-=2![]() 和
和![]()
![]() +
+![]() +2e-=2OH-,则下列叙述正确的是( )
+2e-=2OH-,则下列叙述正确的是( )
A. 通H2的一极是正极,通O2的一极是负极
B. 通O2的一极是正极,通H2的一极是负极
C. 工作是段时间后电解质溶液pH增大
D. 工作时负极区附近pH增大
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:阅读理解
 AgOH+H+
AgOH+H+ AgOH+H+
AgOH+H+
| ||
| ||

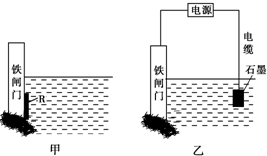 门上的固体材料R可以采用
门上的固体材料R可以采用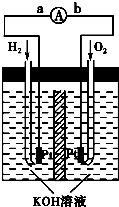 方向为
方向为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 体系 pH[ |
不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.通H2的一极是正极,通入O2的一极是负极
B.通O2的一极是正极,通入H2的一极是负极
C.工作一段时间后,电解质溶液的pH增大
D.工作时负极区附近pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:021
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入质量分数为20%~40%的KOH溶液的多孔碳电极。其电极反应式为:H![]() +2OH--2e-══2H
+2OH--2e-══2H![]() O和
O和![]() +H
+H![]() O+2e-══2OH-。则下列叙述正确的是( )
O+2e-══2OH-。则下列叙述正确的是( )
A.通H2的一极是正极,通入O2的一极是负极
B.通O2的一极是正极,通入H2的一极是负极
C.工作一段时间后,电解质溶液的pH增大
D.工作时负极区附近pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com