
| A. | 晶体中的化学键都具有饱和性和方向性 | |
| B. | 晶体中只要有阴离子,就一定有阳离子 | |
| C. | 石墨是一种典型的原子晶体 | |
| D. | 冰中存在极性共价键和氢键两种化学键 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 金属晶体都是体心立方堆积 | D. | 都能导电、传热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al3+ | Fe3+ | AlO2- | SiO32- | |
| 开始沉淀时 | 3.4 | 1.9 | 10.6 | 7.3 |
| 沉淀完全时 | 4.7 | 3.2 | 9.3 | 5.3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
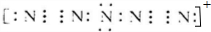 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ④⑤ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com