
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 672×103L |
| 22.4L/mol |
| 1750×103L |
| 22.4L/mol |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 4 |
| 3 |
| 1 |
| 3 |
| ||
|
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| a+a |


科目:高中化学 来源: 题型:
| A、在溴水中存在如下平衡:Br2+H2O?HBr+HBrO 当加入NaOH溶液后颜色变浅 |
| B、对2HI?H2+I2(g)平衡体系增加压强使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0 升高温度使平衡向逆方向移动 |
| D、合成氨反应:N2+3H2?2NH3,△H<0 为使氨的产率提高,理论上应采取低温高压的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常压下五种元素的单质中Z单质的沸点最高 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物还原性小于Y的氢化物 |
| D、Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素中X的金属性最强 |
| B、同周期元素中Y的最高价含氧酸的酸性最强 |
| C、原子半径X>Y,离子半径X+>Z2- |
| D、同族元素中Z的氢化物稳定性最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
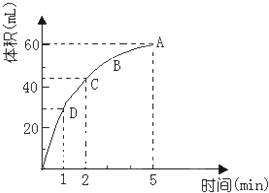 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7 | B、8 | C、9 | D、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、 I2(g)+H2(g)?2HI(g) |
B、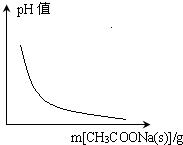 CH3COOH?H++CH3COO-(忽略溶液体积变化) |
C、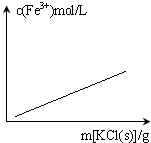 FeCl3+3KSCN?Fe(SCN)3+3KCl(忽略液体体积变化) |
D、 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO(g)-Q(恒压) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com