
1 mol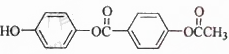 与足量的NaOH溶液充分反应,消耗的NaOH的物质的量为 ( )
与足量的NaOH溶液充分反应,消耗的NaOH的物质的量为 ( )
| A.5 mol | B.4 mol | C.3 mol | D.2 mol |
科目:高中化学 来源: 题型:
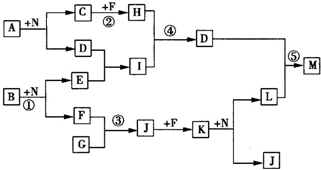 如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知:
如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知: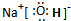
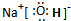
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
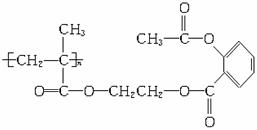
A.n mol B.2n mol C.3n mol D.4n mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某药物结构简式如下图所示,该物质1 mol与足量NaOH溶液反应,消耗NaOH的物质的量为( )
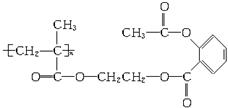
A.n mol B.2n mol C.3n mol D.4n mol
查看答案和解析>>
科目:高中化学 来源: 题型:
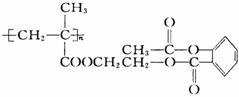
该物质1 mol与足量的NaOH溶液反应,消耗NaOH的物质的量是( )
A.3 mol B.4 mol C.3 n mol D.4 n mol
查看答案和解析>>
科目:高中化学 来源:2011届山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是 ,F的电子式是 。
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的
化学方程式: 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8 mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4 mol/L,此时反应v正 v逆(填“>”、“<”或“=”)。 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度 (填“增大”、“不变”或“减小”),B的转化率
_。(填“升高”、“不变”或“降低”),L的体积分数 (填“增大”、“不变”、“减小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com