
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

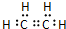 ,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基;
,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基; ,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.
,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把 Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入水中 | |
| D. | 氢氟酸滴到玻璃上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
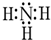 ,分子间存在氢键.
,分子间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com