
| A. | 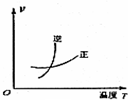 | B. | 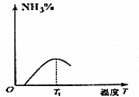 | C. | 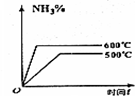 | D. | 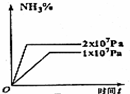 |
分析 A、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动;
B、从温度升高平衡移动的方向来分析,温度升高,平衡逆向移动,氨气的百分含量降低;
C、温度升高反应速率加快,根据平衡移动的方向判断;
D、根据反应方程式的反应物和生成物的化学计量数关系可知,增大压强平衡向正方向移动来判断.
解答 解:A、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动,逆反应速率大于正反应速率,故A正确;
B、温度升高,平衡逆向移动,氨气的百分含量降低,故B正确;
C、温度升高反应速率加快,先达到平衡状态,温度升高平衡向逆反应方向移动,氨气的百分含量降低,故C错误;
D、反应物的化学计量数之和大于生成物的计量数之和,增大压强平衡向正方向移动,氨气的百分含量增大,故D正确.
故选C.
点评 本题考查化学平衡移动的图象题,题目难度不大,做题时注意分析图象曲线特点,从影响平衡移动的因素来分析.


科目:高中化学 来源: 题型:选择题
| A. | 在纯水中加入硫酸或醋酸钠都会抑制水的电离 | |
| B. | 常温下,0.lmo1•Lˉ1氯化铵溶液加水稀释,溶液中的c(OHˉ)增大 | |
| C. | 1mL pH=2的醋酸溶液加水稀释到l0mL,pH变为3 | |
| D. | 常温下,0.1mol•L?1氨水加水稀释,溶液中的c(OHˉ)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
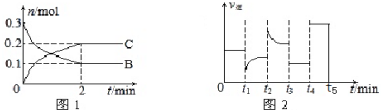
| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
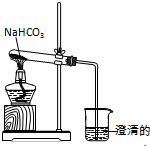 实验室利用图所示装置进行NaHCO3的受热分解实验.
实验室利用图所示装置进行NaHCO3的受热分解实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定等于0.01 | B. | 一定大于0.01 | ||
| C. | 一定大于或等于0.01 | D. | 可能小于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1 mol甲分子内含有10 mol共价键 | |
| B. |  由乙分子构成的物质不能发生氧化反应 | |
| C. |  丙分子的二氯取代产物只有三种 | |
| D. |  分子丁显然是不可能合成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com