
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߡ��ش��������⣺
��1����Ԫ���������______��������ͬ�ĵ��ӣ���______���˶�״̬��ͬ�ĵ��ӣ�д�����������ӵĵ����Ų�ʽ__________________��
��2��![]() �Ŀռ乹�ͺ�
�Ŀռ乹�ͺ�![]() ��ͬ��д��
��ͬ��д��![]() �ĵ���ʽ��__________________��
�ĵ���ʽ��__________________��
��3�����ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵ����ͼʾ��ʾ��

��Ԫ��X��Ԫ�����ڱ��е�λ����__________________��
��д��Ԫ��Y��Z������������Ӧˮ���ﷴӦ�����ӷ���ʽ��______________________________��
�۵�����������Ԫ���зǽ�������ǿ������Ԫ����____________��____________����Ԫ�ط��ţ�����һ����ѧ����ʽ˵��������Ԫ�طǽ����Ե����ǿ����______________________________��
��4������ͬ��Ԫ�ص�ԭ�����γɵļ������У���ԭ����������������____________����������ǿ����������____________��
��5��д������W�ĺ�����Ļ�ѧʽ____________��____________�����һ��ʵ�鷽���Ƚ������������ǿ����д����Ӧ�Ļ�ѧ����ʽ��________________________��
���𰸡�5 14 ![]()
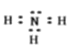 �ڶ����ڵ�VIA��
�ڶ����ڵ�VIA�� ![]() S Cl
S Cl ![]() Cl-
Cl- ![]()
![]()
![]()
![]()
��������
�Ź�ԭ�ӵĵ����Ų�ʽΪ![]() ������������ͬ�ĵ�����5�֣�ÿ�����ӵ��˶�״̬����ͬ���ж��ٵ��Ӿ��ж����˶�״̬��������14���˶�״̬��ͬ�ĵ��ӣ�������Ϊ����㣬�������������Ų�ʽΪ
������������ͬ�ĵ�����5�֣�ÿ�����ӵ��˶�״̬����ͬ���ж��ٵ��Ӿ��ж����˶�״̬��������14���˶�״̬��ͬ�ĵ��ӣ�������Ϊ����㣬�������������Ų�ʽΪ![]() ���ʴ�Ϊ��5��14��
���ʴ�Ϊ��5��14��![]() ��
��
��![]() �ĵ���ʽΪ�� :
�ĵ���ʽΪ�� :![]() :H���ʴ�Ϊ�� :
:H���ʴ�Ϊ�� :![]() :H��
:H��
��
��X�Ļ��ϼ�Ϊ-2�ۣ������ۣ���ΪOԪ�أ��ڵڶ����ڵ�VIA�壬�ʴ�Ϊ���ڶ����ڵ�VIA�壻
��Ԫ��Y��Z�ֱ�ΪNa��Al������������Ӧˮ����ΪNaOH��Al(OH)3�����ӷ�Ӧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��ͬһ�����У��������ҷǽ�����Խ��Խǿ��������ǿ������Ԫ��ΪS��Cl���ǽ�����ǿ��Ԫ�ص��ʿ����û��ǽ��������ĵ��ʣ����Ի�ѧ��Ӧ����ʽΪ![]() ���ʴ�Ϊ��S��Cl��
���ʴ�Ϊ��S��Cl��![]() ��
��
�ȵ��ʵ�������Խǿ����Ӧ���ӵĻ�ԭ��Խ�������ʵĻ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ի�ԭ���������������������ӣ���������ǿ���������������ӣ��ʴ�Ϊ��Cl-��Al3+��
��WΪSԪ�أ�������ֱ�Ϊ![]() ��
��![]() ������ǿ���������ԭ������ѧ��Ӧ����ʽΪ��
������ǿ���������ԭ������ѧ��Ӧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������8�ֻ������У�����ͨ�����Ϸ�Ӧֱ�����ɵ���
��Fe3O4 ��Fe(OH)3 ��FeCl2 ��Cu2(OH)2CO3 ��Al(OH)3 ��Na2CO3 ��NaHCO3 ��Na2O2
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����ø���û���ʾ��ͼ������˵����ȷ���ǣ� ��

A.��ʾ��ͼ˵��ø���и�Ч��
B.ͼʾ�����ܹ���֤ø���ֽϸߵĴ�����
C.һ�������ǿ���ˮ��Ϊ2����������
D.����ø���ܴ���ѿ��ˮ������Ϊ���Dz��ܽ���γ�ø�����︴����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڡ�ͬλ�ء�����ͬ�������塱����ͬϵ�����ͬ���칹�塱��˵���������� ��������
A. ͬλ����ָ��������ͬ����������ͬ��ͬ��Ԫ�صIJ�ͬԭ��
B. ͬ����������ָ��ͬ��Ԫ���γɵIJ�ͬ����
C. ��Ϊͬ���칹����������ʷ���ʽ��ͬ����ѧ����һ������
D. ������ͬ��ͨʽ�������������ɸ���![]() ��ԭ���ŵ��л���һ����Ϊͬϵ��
��ԭ���ŵ��л���һ����Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2(SO4)3��b(NH4)2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ����ȡ�ij����������������(�����������)�������Ϊԭ�ϣ������ͼ����������ȡ������李�
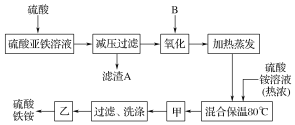
��ش��������⣺
(1)����������Һ�������ữ����ҪĿ����________��
(2)�������������ʺϵ�������B��________��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
(3)������������_____��
(4)���������У�����֮��ͼ�������֮ǰ�����������______(�ѧʽ)������Fe2���Ƿ���ȫ���������ķ���Ϊ_______________��
(5)��ȡ14.00 g���ò�Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ����Һ�м�������NaOH��Һ�����ˡ�ϴ�ӵõ�2.14 g����������һ����Һ�м��뺬0.05 mol Ba(NO3)2����Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�зֱ����������Ľṹģ�ͣ�
A.  B.
B. 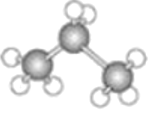
��ش��������⣺
��1��A��B����ģ�ͷֱ����л����____________ģ�ͺ�____________ģ�͡�
��2��ģ��A���Ա�ʾ������ԭ�ӵ����λ�ú���Դ�С���������ʵĿռ�ṹ������ģ��A��ʾ����______��
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
��3����֪��ģ��B��ʾij��M�Ľṹ��������������Ӧ������һ�л���N����M��N��ʽ�����34.5��
��д��M�Ľṹ��ʽ��__________________��
��N�Ŀ��ܽṹ��______�֡���N�ķ�������2�ֲ�ͬ��ѧ��������ԭ�ӣ���ù��̵Ļ�ѧ����ʽ��______________________________���˷�Ӧ��������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�ֻ���ɫ���壬������ˮ���ڻ�������е������������10���Ϳ��ܷ�����ը���ڹ�ҵ�ϳ�����ˮ��������Ư�����ش��������⣺
(1)�ڴ�����ˮʱ��ClO2�ɽ���ˮ�е�CN��������CO2��N2��д���÷�Ӧ�����ӷ���ʽ��________________________��
(2)ijС�鰴���������Ʊ�ClO2�ķ����������ͼ��ʾ��ʵ��װ�������Ʊ�ClO2��

��ͨ�뵪������Ҫ������2����һ�ǿ����������ã�����____________________��
��װ��B��������__________________��
��װ��A��������ClO2���壬�÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
�ܵ�����װ��C�е���Һ������ʱӦ���еIJ�����______________________��
(3)�ⶨװ��C��ClO2��Һ��Ũ�ȣ�ȡ10mLC����Һ����ƿ�У�����������KI��Һ��H2SO4�ữ��Ȼ�����_______________________��ָʾ������0.1000mol��L��1��Na2S2O3��Һ�ζ���ƿ�е���Һ(I2+2S2O32- = 2I- +S4O62-)��������____________________________����ʱ����ñ�Һ���ĵ����Ϊ20.00mL��ͨ�������֪C��ClO2��Һ��Ũ��Ϊ________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2A(g)![]() 2Y(g) + E(g)��H>0�ﵽƽ��ʱ��Ҫʹ����Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
2Y(g) + E(g)��H>0�ﵽƽ��ʱ��Ҫʹ����Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
A.��ѹB.��ѹC.��СE��Ũ��D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����![]() ��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
�ٵμ�Mg��NO3��2��Һ���ڹ��ˣ��۵μ�AgNO3��Һ���ܵμ�Ba(NO3)2��Һ
A.�٢ڢܢڢ�B.�ܢڢ٢ڢ�C.�٢ڢۢڢ�D.�ܢڢۢڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com