
分析 (1)Si、Na2O2的固体混合加入水中,发生的反应有2Na2O2+2H2O=4NaOH+O2↑、
Si+2NaOH+H2O=Na2SiO3+2H2↑,最终得到只含一种溶质的澄清溶液,说明溶液中溶质为Na2SiO3,根据Na2SiO3结合原子守恒知,n(Si)=n(Na2O2),根据m=nM计算混合物的物质的量、各成分质量;
(2)根据转移电子守恒计算生成气体体积;
(3)根据Si原子守恒计算n(Na2SiO3),由c=$\frac{n}{V}$计算其浓度.
解答 解:(1)Si、Na2O2的固体混合加入水中,发生的反应有2Na2O2+2H2O=4NaOH+O2↑、Si+2NaOH+H2O=Na2SiO3+2H2↑,最终得到只含一种溶质的澄清溶液,说明溶液中溶质为Na2SiO3,根据Na2SiO3结合原子守恒知,n(Si)=n(Na2O2),设n(Si)=n(Na2O2)=xmol,则28xg+78xg=10.6g,x=0.1,所以n(Si)=n(Na2O2)=0.1mol,
则m(Si)=28g/mol×0.1mol=2.8g,
故答案为:2.8;0.1;
(2)根据转移电子守恒生成V(O2)=$\frac{0.1mol}{2}$×22.4L/mol=1.12L、生成V(H2)=$\frac{0.1mol×4}{2}$×22.4L/mol=4.48L,所以生成气体总体积=1.12L+4.48L=5.6L,
故答案为:5.6;
(3)根据Si原子守恒计算n(Na2SiO3)=n(Si)=0.1mol,由c(Na2SiO3)=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1.
点评 本题考查混合物的有关计算,为高频考点,侧重考查学生分析计算能力,明确发生的反应、各个物理量关系是解本题关键,注意转移电子守恒、原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mL pH=10的氨水和100mLpH=4的甲酸溶液导电性相同 | |
| B. | pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 | |
| C. | 稀释pH=10的氨水,溶液中所有离子的浓度均降低 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4:3 | B. | 7:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量等浓度的NaOH溶液 | B. | 加入适量水 | ||
| C. | 通入适量H2S气体 | D. | 加入适量等浓度的NaHS溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+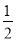 O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
C(s)+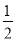 O2(g)=CO(g)△H=﹣bkJ•mol﹣1
O2(g)=CO(g)△H=﹣bkJ•mol﹣1
Cu(s)+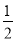 O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJ•mol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
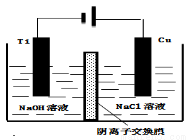
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5mol•L﹣1•min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
在日常生活中,我们经常看到铁制品生锈、钒制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )

A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图II是图I所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电 极反应:2Cl--2e-=Cl2↑
极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g),忽略固体体积,平衡时C的体积分数
2C(g),忽略固体体积,平衡时C的体积分数 (%)随温度和压强的变化如下表所示:
(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
800 | 54.0 | a | b |
900 | c | 75.0 | d |
1000 | e | f | 83.0 |
①a﹤b ②该反应的熵变△S﹤0 ③900℃、2.0MPa时A的转化率为60%
④K(1000℃)﹥K(800℃) ⑤正反应为吸热反应 上述①~⑤中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com