
| A. | 水电离出的c(H+)=1.0×10-13mol/L的溶液中,Na+、NH4+、Cl-、SO42- | |
| B. | 滴入甲基橙试液变红色的溶液中:Cl-、AlO2-、HCO3-、NH4+ | |
| C. | 加入少量KSCN后变为红色的溶液中:K+、Mg2+、I-、NO3- | |
| D. | 无色透明的溶液中:CH3COO-、CO32-、K+、Na+ |
分析 A.水电离出的c(H+)=1.0×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应;
B.滴入甲基橙试液变红色的溶液中存在大量氢离子,碳酸氢根离子酸性大于氢氧化铝,偏铝酸根离子与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子,且偏铝酸根离子和碳酸氢根离子都与氢离子反应;铵根离子与偏铝酸根离子发生双水解反应;
C.加入少量KSCN后变为红色的溶液中存在铁离子,铁离子能够氧化碘离子;
D.四种离子之间不反应,且为无色透明溶液.
解答 解:A.水电离出的c(H+)=1.0×10-13mol/L的溶液为酸性或碱性溶液,铵根离子与碱性溶液反应,在溶液中不能大量共存,故A错误;
B.滴入甲基橙试液变红色的溶液为酸性溶液,溶液中存在大量氢离子,AlO2-、HCO3-之间反应生成氢氧化铝沉淀和碳酸根离子,AlO2-、HCO3-都与氢离子反应,AlO2-、NH4+发生双水解反应,在溶液中不能大量共存,故B错误;
C.加入少量KSCN后变为红色的溶液中存在铁离子,铁离子具有氧化性,能够氧化I-,在溶液中不能大量共存,故C错误;
D.CH3COO-、CO32-、K+、Na+之间不反应,都是无色离子,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
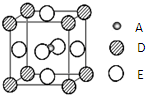 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
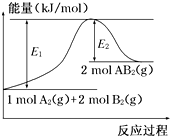 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com