
分析 (1)①氧化还原反应中,化合价升高的数值=化合价降低数值=转移电子数;
②反应的平衡表达式等于生成物浓度幂之积比上反应物浓度幂之积;
③化学反应是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是气体计量数增大的反应,提高NOx的转化率,平衡正向移动,由此分析解答;
(2)根据盖斯定律来计算化学反应的焓变;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,根据化学方程式结合电子守恒来计算;
(4)①根据图中信息知道:CO(NH2)2与某种烟气中的NO的物质的量比值越大,NO脱除率越大.
解答 解:(1)根据化合价升高的数值=化合价降低数值=转移电子数,化合价升高情况:2NH3~6e-~N2,所以当有1mol N2(g)生成,该反应的电子转移的量是6mol,总数是6NA 或6×6.02×1023,故答案为:6NA 或6×6.02×1023;
②反应的平衡表达式等于生成物浓度幂之积比上反应物浓度幂之积,所以K=$\frac{c2(N2)•c3(H2O)}{c2(NH3)•c(NO)•c(NO2)}$,故答案为:$\frac{c2(N2)•c3(H2O)}{c2(NH3)•c(NO)•c(NO2)}$;
③化学反应是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是气体计量数增大的反应,提高NOx的转化率,平衡正向移动,
a.增大NH3的浓度,反应速率加快,平衡正向移动,故正确;
b.增大N2的浓度,平衡逆向,NOx的转化率减小,故错误;
c.增大压强,平衡逆向移动,故错误;
d.选择合适的催化剂,平衡不移动,故错误;
故选:a;
(2)根据盖斯定律,将已知热化学方程式②×2-①可得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ•mol-1,故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ•mol-1;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl,根据物质的性质及化合价变化可知:2NO~5e-~NO2+HNO3,ClO2~5e-~HCl,所以有2NO2~ClO2.根据物质的性质及化合价变化可知:2NO2~8e-~N2,Na2SO3~2e-~Na2SO4,所以有2NO2~4 Na2SO3.根据关系式有:2ClO2~2NO2~N2,n(ClO2)=2n(NO2)=1 mol,m(ClO2)=67.5g,
故答案为:2NO+ClO2+H2O=NO2+HNO3+HCl;67.5.
点评 本题涉及氧化还原反应中的概念、盖斯定律的应用、化学平衡的有关计算等综合知识,注意知识的迁移和应用是关键,难度大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
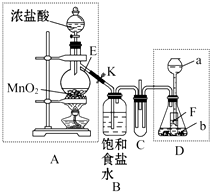 某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置.实验时将A、D中产生的气体同时通入C中.(K为止水夹,部分夹持仪器已略去)
某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置.实验时将A、D中产生的气体同时通入C中.(K为止水夹,部分夹持仪器已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 石蕊试液 | 品红溶液 | 饱和硫化氢溶液 | 氯水 | |
| A | 无色 | 无色 | 乳白色浑浊 | 无色 |
| B | 红色 | 无色 | 黄色浑浊 | 无色 |
| C | 红色 | 无色 | 乳白色浑浊 | 黄绿色 |
| D | 无色 | 无色 | 乳白色浑浊 | 黄绿色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的同分异构体有四种 | |
| B. | 分子式为C8H10的芳香烃有3个,分别为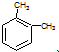 、 、 和 和 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 锌摄入量过多,也会引起缺铁性贫血 | |
| D. | 为了防止龋齿,人人都适合使用含氟牙膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于净水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | 氯元素在自然界主要以氯气形式存在 | |
| D. | 氯气被广泛用于医药合成、农药生产等方面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com