
【题目】钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。KClO4中氯元素的化合价是_________,具有_________(填“还原性”或“氧化性”);Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做_________(填“还原剂”或“氧化剂”)。
(2)甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe粉和稀H2SO4 , B管中是NaOH溶液,请回答下列问题:
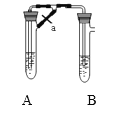
①同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是____________写出B中发生反应的所有离子方程式:___________________
②同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是__________ ;
③同学乙打开a的目的______________,根据以上实验判断___________(填甲或乙)同学可成功。
【答案】+7 氧化性 还原剂 生成灰白色沉淀迅速变成灰绿色,最后变成红褐色 Fe+2H+=Fe2++H2↑、Fe2++2OH-=Fe(OH)2↓ 有白色沉淀生成 使A管中产生的气体通入B管中赶走空气 乙
【解析】
(1)KClO4中氯元素的化合价为+7价,具有氧化性;反应6Na + Fe2O3 =3Na2O + 2Fe中Na元素化合价升高;
(2)①Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气导致溶液通过导管进入B装置,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3;
②生成的氢气将空气排出,发生反应:Fe2++2OH-=Fe(OH)2↓,能防止氢氧化亚铁被氧化;
③只要没有空气就能防止氢氧化亚铁被氧化,据此来回答。
(1)KClO4中氯元素的化合价为+7价,为最高价态,具有氧化性,反应6Na + Fe2O3 =3Na2O + 2Fe中Na元素化合价升高,被氧化,为还原剂;
(2)①A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入B试管,B中反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3,所以看到的现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,整个过程中涉及反应的离子方程式有Fe+2H+=Fe2++H2↑、Fe2++2OH-=Fe(OH)2↓;
②先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是:有白色沉淀生成(且不变色);
③通过以上分析知,乙同学的实验:先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,这样A中生成的氢气将空气排出,可制取纯净的Fe(OH)2。


科目:高中化学 来源: 题型:
【题目】下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
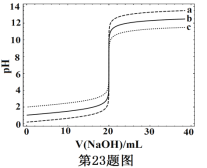
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下100mL0.1mol/L醋酸溶液中含H+为0.01NA
B.1molNa与足量O2反应生成Na2O和Na2O2的混合物共失去NA个电子
C.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为 NA
D.7.8gNa2O2的固体中含有的阴离子数0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是
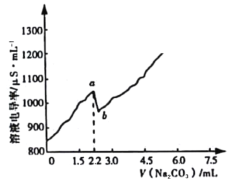
A.a点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
D.右图可以说明CaCO3在溶液中存在过饱和现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Ca2CO3, XO2(X= Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)基态硼原子的价电子排布图是____________,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为________________。
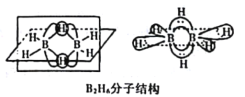
(2)B的简单氢化物BH3,不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为____________________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________,写出一种与氨硼烷互为等电子体的分子_________(填分子式)。
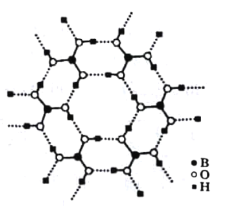
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为_______;硼酸在热水中比在冷水中溶解度显著增大的主要原因是____________。
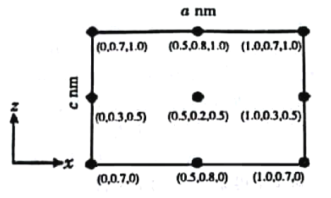
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为anm、bnm和cnm.如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_________;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____g·cm-3(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )
A. 通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1
B. 通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1
C. 若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1 , 则a>286
D. 制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置于低温处
B.对2HI(g) ![]() H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com