
 =0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,
=0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量, SO2(g)△H=-296kJ/mol,
SO2(g)△H=-296kJ/mol, SO2(g)△H=-296kJ/mol;
SO2(g)△H=-296kJ/mol; HSO3-+OH-;HSO3-+H2O
HSO3-+OH-;HSO3-+H2O H2SO3+OH-,则溶液呈碱性,
H2SO3+OH-,则溶液呈碱性, HSO3-+OH-;HSO3-+H2O
HSO3-+OH-;HSO3-+H2O H2SO3+OH-;c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
H2SO3+OH-;c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+); H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH, H2↑+Cl2↑+2NaOH.
H2↑+Cl2↑+2NaOH.

科目:高中化学 来源: 题型:阅读理解
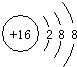
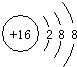
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子气态分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
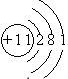



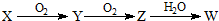
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
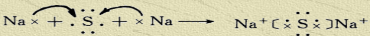
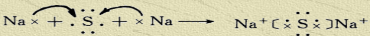


查看答案和解析>>
科目:高中化学 来源: 题型:
 北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com