

分析 (1)根据溶液的pH大小来判断溶液的酸碱性强弱;
(2)弱碱的电离是分步进行的,根据电离方程式的书写方法来回答;
(3)用0.10mol•L-1盐酸滴定20.00mL0.10mol•L-1的R0H溶液(B),碱是弱碱,二者之间反应得到强酸弱碱盐,显示酸性,据此回答.
解答 解:(1)根据图象判断,等浓度的碱A和B,0.10mol•L-1的M0H溶液(A)pH=13,所以是强碱,故答案为:强碱;0.10mol•L-1的M0H溶液(A)pH=13;
(2)0.10mol•L-1的R0H溶液(A)pH<13,所以是弱碱,部分电离,电离方程式为:ROH?R++OH-;故答案为:ROH?R++OH-;
(3)0.10mol•L-1盐酸滴定20.00mL0.10mol•L-1的R0H溶液(B),碱是弱碱,二者之间反应得到强酸弱碱盐,显示酸性,pH=7对应的溶液是RCl和剩余的ROH的混合物,根据电荷守恒:c(R+)+c(H+)=c(OH-)+c(Cl-),pH=7对应的溶液中,c(H+)=c(OH-),所以c(R+)=c(Cl-),溶液浓度大小排序为:c(R+)=c(Cl-)>c(H+)=c(OH-),故答案为:(R+)=c(Cl-)>c(H+)=c(OH-).
点评 本题涉及酸碱中和滴定以及溶液中离子浓度大小比较方面的知识,注意溶液的组成以及若酸碱的不完全电离是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeCl2(FeCl3)--加入足量铁粉,然后过滤,Fe+2FeCl3═3FeCl2 | |
| B. | NaCl(NaI)--加入适量氯水,用CCl4萃取分液,Cl2+2NaI═2NaCl+I2 | |
| C. | SiO2(Al2O3)--加入足量NaOH溶液,然后过滤,Al2O3+2NaOH═2NaAlO2+H2O | |
| D. | CaCl2(NH4Cl) 固体混合物--直接加热NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2(CCl4)→ | B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | ||
| C. | C(CH3)4+Cl2$\stackrel{光照}{→}$ | D. | n CH3-CH=CH2$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Cr2O${\;}_{7}^{2-}$ | C. | Br2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

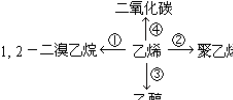
 ③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 向漂白粉溶液中加入过量浓盐酸:ClO-+H+=HClO | |
| C. | “万能还原剂”NaBH4与水反应得到NaBO2:BH4-+2H2O=BO2-+4H2↑ | |
| D. | 向FeSO4溶液中加入Na2O2:2Na2O2+2Fe2++2H2O=4Na++2Fe(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com