
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D.次氯酸钠可以与亚硫酸钠共存
【知识点】氧化还原反应规律 氯及化合物的性质B3 D2
【答案解析】D 解析:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,说明次氯酸根能氧化碘离子,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,说明亚硫酸钠能将碘单质还原,A、根据氧化剂的氧化性强于氧化产物,故A正确;B、漂白粉溶液可使碘化钾使淀粉碘化钾试纸变蓝,故B正确;C、向氯水中加入亚硫酸钠溶液,亚硫酸钠能将氯水还原,氯水褪色,故C正确;D、次氯酸钠与亚硫酸钠会发生氧化还原反应,不能共存,故D错误。
故答案选D
【思路点拨】本题考查氧化还原反应规律,关键是根据题目描述得到氧化性顺序:ClO –>I2>SO42– 。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.常温常压下,46 g有机物C2H6O中含有极性键的数目一定为7NA
B.标准状况下,22.4 L四氯化碳中所含有的共价键数目为4NA
C.标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA
D.常温常压下,33.6 L氯气与56 g铁充分反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
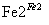 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是 ( )
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.NH4Cl + 2H2O  NH3·2H2O + HCl
NH3·2H2O + HCl
C.2KMnO4 + 5H218O2 + 3H2SO4= K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
从硫化物中提取单质锑,经历以下两个过程: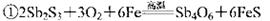
②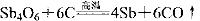 关于反应①、②的说法不正确的是
关于反应①、②的说法不正确的是
A.反应①中Sb元素被氧化
B.反应②中Sb元素被还原
C.标准状况下,每生成4 mol Sb时,消耗67.2LO2
D.反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有大量化学物质,是巨大的化学资源宝库,利用海水资源可以获取一系列化 工产品。
工产品。

(1)请写出电解饱和食盐水的化学方程式:  。
。
(2)在 电解饱和食盐水的装置中,阴极产生的气体为 。
电解饱和食盐水的装置中,阴极产生的气体为 。
为了降低能耗,充分利用氯碱工业产品进行联合生产的方法得 到推广应用。
到推广应用。
根据上图,请回答下列问题:
(3)X气体为 (填化学式)。
(4)写出图中燃料电池负极的电极反应: 。
(5)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少 量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。
量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。

已知将上述处理液加水稀释后,立即析出大量白色沉淀,请写出该反应的离子方程式: 。
(6)已知:①Mg(s)+Cl2(s) MgCl2(s) ΔH=-641 kJ·mol-1
MgCl2(s) ΔH=-641 kJ·mol-1
②Ti(s)+Cl2(g) TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:  ;该反应过程中还应控制的反应条件是 。
;该反应过程中还应控制的反应条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别列表如下:
| 一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由表中数据可以推断,熔点为234℃的一溴代二甲苯的结构简式为______________;熔点为-54℃的二甲苯的名称为__________________________________。
(2)  的名称为______________。
的名称为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com