
【题目】某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
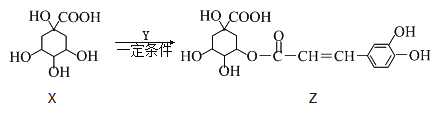
下列有关叙述中不正确的是( )
A. Z结构中有4个手性碳原子
B. Y的分子式为C9H8O3
C. 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D. Z与浓溴水既能发生取代反应又能发生加成反应
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成-种具有果香味的物质C和化合物d的合成路线如下图所示。回答下列问题:
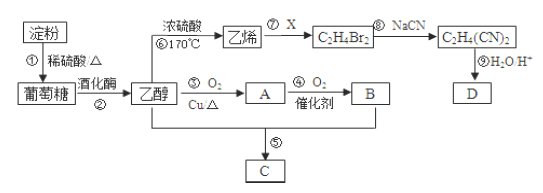
(1)B分子中的官能团名称为_______________。
(2)反应⑧的反应类型为_______________。
(3)反应③的化学方程式为_________________。反应⑤的化学方程式为___________________。
(4)反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是_______________。
(5)己知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D能发生酯化反应,且分子中只有两种不同化学环境的氢,则D的结构简式______________。
(6)请补充完整检验反应①淀粉水解程度的实验方案:取反应①的溶液2mL于试管中,_____________。
实验中可供选择的试剂:10%的NaOH溶液、新制Cu(OH)2悬浊液、碘水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T五种,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是

A. 离子半径:Y<Z
B. 氢化物的稳定性:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z三种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在溶液中能够大量共存,当溶液中c(H+)=1×10-1mol·L-1时,有气体产生,而当溶液中c(H+)=1×10-13 mol·L-1时,又能生成沉淀。则该组离子可能为( )
A. HCO![]() 、Na+、Al3+、NO
、Na+、Al3+、NO![]() B. Fe2+、Na+、SO
B. Fe2+、Na+、SO![]() 、NO
、NO![]()
C. Mg2+、NH![]() 、SO
、SO![]() 、Cl- D. Na+、MnO
、Cl- D. Na+、MnO![]() 、NO
、NO![]() 、S2-
、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中所列字母分别代表一种元素。
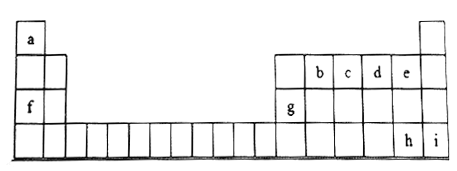
根据表格所给信息,回答下列问题:
(1)c元素原子的最高价氧化物对应的水化物的化学式___________(填化学式)
(2)b、c、d、e的原子半径依次_______(填“增大”或“减小”)
(3)e、h元素原子形成的氢化物中,热稳定性大的是__________(填氢化物的化学式)
(4)f、g元素的最高价氧化物对应水化物之间发生反应的化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO2-4=BaSO4↓+H2O
③碳酸氢钠溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④氢氧化钠中滴加醋酸:OH-+H+=H2O
A. ①③④ B. ①③ C. ②④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素的性质及其递变规律正确的是( )
A. 第二周期元素从左到右,最高正价从+1递增到+7
B. 同一主族的元素,原子半径越大,越容易失去电子,其单质的氧化性越强
C. 最外层电子数比次外层电子数多的元素一定位于第二周期
D. 碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
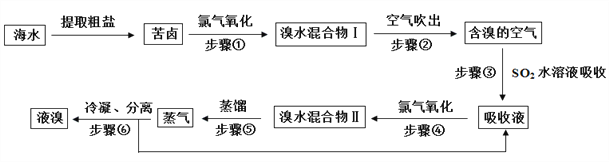
(1)步骤①获得Br2的离子反应方程式为:________________________________________;
(2)步骤③所发生反应的化学方程式为:________________________________________。在该反应中,氧化剂是______________(填化学式);若反应中生成2molHBr,则转移电子数约为_____________个。
(3)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:_______________
(4)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(5)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:________________。(6)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作还原剂的是
A. BaO+H2O===Ba(OH)2 B. 3Fe+4H2O===Fe3O4+4H2↑
C. 2F2+2H2O===4HF+O2 D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com