
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
分析 A.标准状况下气体摩尔体积为22.4L/mol;
B.12g石墨和C60的混合物中含有12gC原子,12个C原子的物质的量为1mol,含有6mol质子;
C.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,而且FeCl3溶液的体积不明确;
D..1个氧气分子得到4个电子生成二价氧,正极电极反应为:O2+2H2O+4e-=4OH-.
解答 解:A.标准状况下,三氧化硫标准状况下不是气体,11.2LSO3物质的量不是0.5mol,故A错误;
B.12g石墨和C60的混合物中含有12个碳原子,含有1mol碳原子,1mol碳原子含有6mol质子,所以混合物中含有的质子总数一定为6NA个,故B正确;
C.FeCl3溶液的体积不明确,即无法计算FeCl3的物质的量,而且一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故无从得知胶粒的个数,故C错误;
D.氢氧燃料电池正极消耗22.4L(标准状况)气体位氧气,物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,O2+2H2O+4e-=4OH-,电路中通过的电子数目为4NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下的气体摩尔体积的使用条件、原电池原理,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


科目:高中化学 来源: 题型:选择题
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+,NH4+,NO3-MnO4- | B. | Mg2+,SO42-,K+,Cl- | ||
| C. | K+,Cu2+,Cl-,Br- | D. | Ba2+,Na+,OH-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
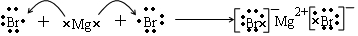 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用两只量筒分别量取所需氢氧化钠和盐酸 | |
| B. | 两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度 | |
| C. | 仪器装置保温隔热的效果要好,且操作动作要迅速 | |
| D. | 所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
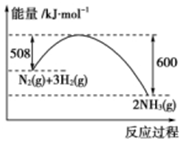 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com