
| A. | Na2CO3+H2S=NaHCO3+NaHS | B. | Na2S+H2O+CO2=NaHS+NaHCO3 | ||
| C. | 2NaHCO3+H2S=Na2S+2H2O+2CO2 | D. | NaHS+H20+CO2=NaHCO3+H2S |
分析 弱酸的电离程度越大,弱酸的酸性越强,据其电离程度可知,H2CO3、H2S、HCO3-酸性依次减弱,依据强酸制备弱酸的原理判断反应能否发生,据此解答.
解答 解:A.H2S的酸性比HCO3-酸性强,比H2CO3酸性弱,所以H2S与碳酸钠反应生成NaHCO3和NaHS,故A正确;
B.H2CO3、H2S、HCO3-酸性依次减弱,所以碳酸与硫化钠反应生成NaHS和NaHCO3,故B正确;
C.碳酸酸性比氢硫酸强,氢硫酸与碳酸氢钠反应不可能生成碳酸,故C错误;
D.H2S的酸性比HCO3-酸性强,碳酸与硫氢化钠反应生成NaHCO3和H2S,故D正确;
故选C.
点评 本题考查了弱电解质的电离及其应用,题目难度中等,明确电离平衡常数与酸性强弱的关系为解答关键,注意掌握强酸制取弱酸的原理,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到上层液体呈紫色 | |
| B. | 液溴有强挥发性,保存时应加少量水液封 | |
| C. | Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质 | |
| D. | HX的还原性顺序为:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
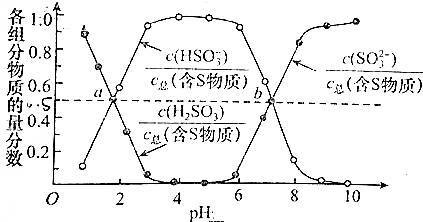
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
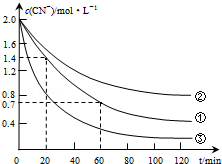
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com