
| A. | 油脂在酸性条件下水解的反应称为皂化反应 | |
| B. | 煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 | |
| C. | 石油裂化的目的是提高轻质油的产量和质量 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |
分析 A.油脂碱性条件下水解制备肥皂;
B.煤的气化和液化是化学变化;
C.石油裂化的目的是为了提高轻质液体燃料(汽油、煤油、柴油等)的产量;
D.加入饱和硫酸铵溶液,发生盐析.
解答 解:A.油脂碱性条件下水解制备肥皂,则油脂碱性条件下水解反应为皂化反应,故A错误;
B.煤的气化是让煤在高温条件下与水蒸气反应生成氢气和一氧化碳;煤的液化是利用煤制取甲醇的反应,故均为化学变化,故B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油、煤油、柴油等)的产量,特别是提高汽油的产量,故C正确;
D.加入饱和硫酸铵溶液,发生盐析,而加入重金属盐、高温等可发生蛋白质的变性,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重油脂、蛋白质性质的考查,注意石油的综合利用,题目难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
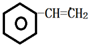 ,C的结构简式:
,C的结构简式: .
.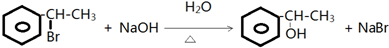 .
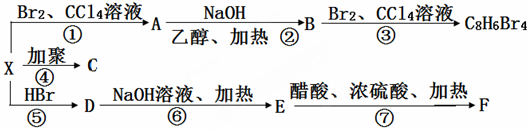
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 由水电离出c(H+)=10-3 mol•L-1的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CH3CH2OH | C. | CH3CHO | D. | C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com