
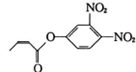
 ,该分子中官能团(不含苯环)不含有( )
,该分子中官能团(不含苯环)不含有( )| A. | 酯基 | B. | 碳碳双键 | C. | 醚键 | D. | 硝基 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ICN不能和NaOH溶液作用 | |
| B. | ICN是一种离子化合物 | |
| C. | ICN可以和NaI作用生成单质碘 | |
| D. | ICN空气中受热也能发生题中所述分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s) $\stackrel{△}{→}$Na2CO3(s) | |
| B. | CuCl2$\stackrel{NaOH(aq)}{→}$ Cu(OH)2 $→_{△}^{葡萄糖}$Cu | |
| C. | Al $\stackrel{NaOH(aq)}{→}$ NaAlO2(aq) $\stackrel{△}{→}$ NaAlO2(s) | |
| D. | MgO(s)$\stackrel{HNO_{3}(aq)}{→}$ Mg(NO3)2(aq) $\stackrel{电解}{→}$ Mg(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | 用活性炭为糖脱色和用臭氧白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.05mol Na2O2固体中含有的阴离子数为0.05NA | |
| B. | 标准状况下,2.24L CH4所含的原子数为0.5NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol•L-1氨水中含有的NH3•H2O分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
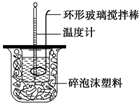 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )| A. | 实验装置中小烧杯杯中低于大烧杯杯口 | |
| B. | 用浓硫酸代替了稀硫酸 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5517.6kJ•mol-1 | |
| C. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑥ | C. | ①③⑤⑥ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
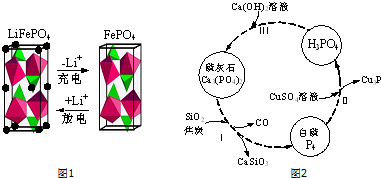
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com