
Ņ»¶ØĪĀ¶ČĻĀ2LµÄŗćČŻČŻĘ÷¼×ÖŠ£¬¼ÓČė2moLĢ¼ŗĶ2moLCO2·¢ÉśČēĻĀ·“Ó¦£ŗ
C(s)+CO2(g)  2CO(g)”””÷H£¾0
2CO(g)”””÷H£¾0
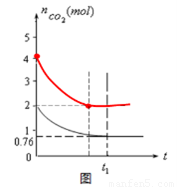
²āµĆČŻĘ÷ÖŠCO2µÄĪļÖŹµÄĮæĖꏱ¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£

£Ø1£©øĆ·“Ó¦µÄ¦¤S”””” 0£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”£ŌŚ”””” £ØĢī”°½Ļøß”±»ņ”°½ĻµĶ”±£© ĪĀ¶ČĻĀÓŠĄūÓŚøĆ·“Ó¦×Ō·¢½ųŠŠ”£
£Ø2£©ĮŠŹ½²¢¼ĘĖćÉĻŹöĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK”””””””” ”””””””” ”££Ø½į¹ū±£ĮōŅ»Ī»Š”Źż£©
£Ø3£©ĻņÉĻŹöĘ½ŗāĢåĻµÖŠŌŁĶØČėCO2£¬ŌņCO2µÄ×Ŗ»ÆĀŹ”””””” £ØĢīŌö“󔢼õŠ””¢²»±ä”¢ĪŽ·ØČ·¶Ø£©”£
£Ø4£©ĻąĶ¬ĪĀ¶ČĻĀ£¬2LµÄŗćČŻČŻĘ÷±ūÖŠ¼ÓČė4moLĢ¼”¢4moLCO2ŗĶ4moLCO”£æŖŹ¼·“Ó¦Ź±v(Õż)”””””””” v(Äę)£ØĢī£¾”¢ £¼”¢©£©”£
£Ø5£©ĻąĶ¬ĪĀ¶ČĻĀ£¬2LµÄŗćČŻČŻĘ÷ŅŅÖŠ¼ÓČė4moLĢ¼ŗĶ4moLCO2£¬“ļµ½Ę½ŗā”£ĒėŌŚĶ¼ÖŠ»³öŅŅČŻĘ÷ÖŠCO2µÄĪļÖŹµÄĮæĖꏱ¼ät±ä»Æ¹ŲĻµµÄŌ¤ĘŚ½į¹ūŹ¾ŅāĶ¼”££Ø×¢Ć÷Ę½ŗāŹ±CO2µÄĪļÖŹµÄĮ棩
£Ø1£©>”” ½ĻøߣØ2·Ö£¬ø÷1·Ö£©
£Ø2£©K=c2(CO)/c(CO2)=1.242/0.38=4.0 (3·Ö)
£Ø3£©¼õÉŁ£Ø2·Ö£©
£Ø4£© >£Ø2·Ö£©
£Ø5£©ČēĶ¼ £Ø3·Ö£©
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©Éś³ÉĪļÖŠĘųĢåµÄ»Æѧ¼ĘĮæŹżÖ®ŗĶ“óÓŚ·“Ó¦ĪļÖŠĘųĢåµÄ»Æѧ¼ĘĮæŹżÖ®ŗĶ£»øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£»
£Ø2£©Ę½ŗā³£ŹżŹĒÖøæÉÄę»Æѧ·“Ó¦“ļµ½Ę½ŗāŹ±£¬Ćæøö²śĪļÅضČĻµŹż“ĪĆŻµÄĮ¬³Ė»żÓėĆæøö·“Ó¦ĪļÅضČĻµŹż“ĪĆŻµÄĮ¬³Ė»żÖ®±Č£»
£Ø3£©ĶØČė¶žŃõ»ÆĢ¼Ź¹ĘäÅضČŌö“ó£¬Ę½ŗāĻņÓŅŅĘ¶Æ£¬µ«ĘäµÄ×Ŗ»ÆĀŹ½µµĶ£»
£Ø4£©ŅņĪŖ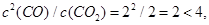 ĖłŅŌĘ½ŗāĻņÓŅŅĘ¶Æ£¬Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£»
ĖłŅŌĘ½ŗāĻņÓŅŅĘ¶Æ£¬Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£»
£Ø5£©ŅņĪŖ µÄÅضČŌö“ó£¬ĖłŅŌ·“Ó¦ĖŁĀŹ¼Óæģ£¬“ļµ½Ę½ŗāµÄŹ±¼ä¼õÉŁ£¬ÉčĻūŗÄXmol
µÄÅضČŌö“ó£¬ĖłŅŌ·“Ó¦ĖŁĀŹ¼Óæģ£¬“ļµ½Ę½ŗāµÄŹ±¼ä¼õÉŁ£¬ÉčĻūŗÄXmol ,ŌņÓŠ
,ŌņÓŠ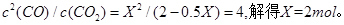
æ¼µć£ŗ»ÆŃ§Ę½ŗāÓė×Ŗ»ÆĀŹ”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | - | - | - |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŅ»2LµÄŗćČŻĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molN2ŗĶ0.6mol H2£¬·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0£®·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼ĖłŹ¾£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŅ»2LµÄŗćČŻĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molN2ŗĶ0.6mol H2£¬·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0£®·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼ĖłŹ¾£ŗ| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| [HCOO-] | [HCOOH]?[OH-] |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğĮÉÄžŹ”ŠĀĆńŹŠøßČżÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
µŖÓŠ¶ąÖÖŃõ»ÆĪļ£¬ĘäÖŠN2O5ŹĒŅ»ÖÖŠĀŠĶĻõ»Æ¼Į£¬ĘäŠŌÖŹŗĶÖʱøŹÕµ½ČĖĆĒµÄ¹Ų×¢”£
£Ø1£©Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠN2O5æÉ·¢ÉśĻĀĮŠ·“Ó¦£ŗ2N2O5(g)
 4NO2(g)£«O2(g) £»ØSH£¾0
4NO2(g)£«O2(g) £»ØSH£¾0
¢Ł·“Ó¦“ļµ½Ę½ŗāŗó£¬ČōŌŁĶØČėŅ»¶ØĮæė²Ęų£¬ŌņN2O5µÄ×Ŗ»ÆĀŹ½«___£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±”¢”°²»±ä”±£©”£
¢ŚĻĀ±ķĪŖ·“Ó¦ŌŚT1ĪĀ¶ČĻĀµÄ²æ·ÖŹµŃ鏿¾Ż£ŗ
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol”¤L”Ŗ1 |
5.00 |
3.52 |
2.48 |
Ōņ500sÄŚN2O5µÄ·Ö½āĖŁĀŹĪŖ______________”£
¢ŪŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LŗćČŻĆܱÕČŻĘ÷ÖŠ¼ÓČė2mol
N2O5£¬“ļµ½Ę½ŗāŹ±£¬ĘųĢåµÄŃ¹ĒæĪŖŌĄ“µÄ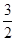 £¬(²»æ¼ĀĒNO2¾ŪŗĻ³ÉN2O4)£¬ŌņN2O5µÄ×Ŗ»ÆĀŹa1£½ £¬øĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK£½_______”£
£¬(²»æ¼ĀĒNO2¾ŪŗĻ³ÉN2O4)£¬ŌņN2O5µÄ×Ŗ»ÆĀŹa1£½ £¬øĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK£½_______”£
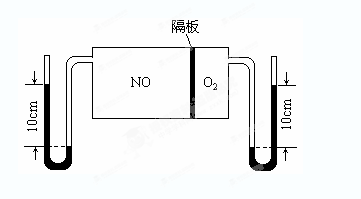
£Ø2£©ČēĶ¼ĖłŹ¾×°ÖĆæÉÓĆÓŚÖʱøN2O5£¬ŌņN2O5ŌŚµē½ā³ŲµÄ__________ĒųÉś³É£¬Ęäµē¼«·“Ó¦Ź½ĪŖ_________________________________”£

£Ø3£©ČēĶ¼£ŗV(NO):V(O2)£½3:1”£µ±³éČ„NOŗĶO2Ö®¼äµÄøō°åŗó£¬NOŗĶO2·“Ó¦ŗó³ÉNO2£¬²æ·ÖNO2¾ŪŗĻ³ÉN2O4£ØN2O4“ĖŹ±ĪŖĘųĢ¬£©”£µ±ĢåĻµ“ļµ½Ę½ŗāŗó£¬UŠĪĆ«Ļø¹ÜĮ½¶Ė¹ÆĆęøß¶Č²īÓÉ·“Ó¦Ē°10cm±äĪŖ7.1cm”£¼ŁÉčĪĀ¶Č²»±ä£¬ĒŅøō°å¼°UŠĪĆ«Ļø¹ÜµÄĢå»ż¶¼ŗöĀŌ²»¼Ę£¬“ĖŹ±»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ__________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com