
| A.氢氧化钠溶液 | B.稀硫酸 | C.盐酸 | D.稀硝酸 |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑦ | B.②③⑥⑧ | C.②④⑥⑦ | D.③⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
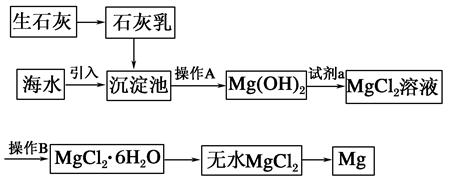
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
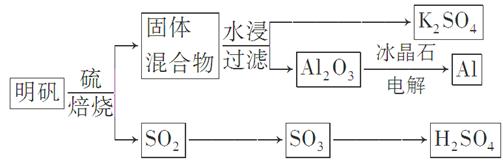 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.导致易拉罐变瘪的离子反应是:CO2+OH-=HCO3- |
B.导致易拉罐又鼓起来的反应是:Al3++3HCO3-=Al(OH)3+3CO2 |
| C.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
| D.上述过程中总共发生了三个化学反应,且反应结束后的溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
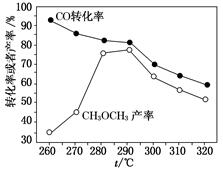
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属镁着火时可用干冰灭火 |
| B.二氧化硅可用作光导纤维 |
| C.往氯水中通入SO2后,溶液的漂白性增强 |
| D.由于铝在常温下不与氧气反应,所以铝制品具有抗腐蚀性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
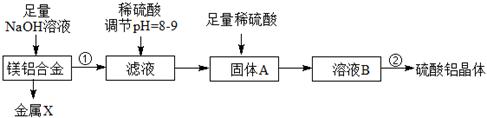
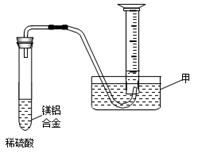
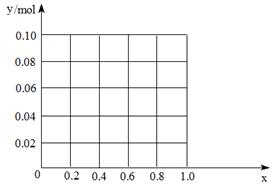
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com