
| |||||||||||||||
(1) |
NH4Al(SO4)2 |
(2) |
①③②⑤④ |
(3) |
答案:①Al3++3OH- 解析:硫酸铝铵为类似于明矾的复盐,完全电离出NH4+、Al3+、 |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
 (2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.
(2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源:上海市十三校2012届高三第二次联考化学试题 题型:022
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
1.用甲烷催化还原一氧化氮,可以消除一氧化氮对大气的污染.反应方程式如下:CH4(g)+4NO(g)![]() 2N2(g)+2H2O(g)+CO2(g)该反应平衡常数表达式为________.
2N2(g)+2H2O(g)+CO2(g)该反应平衡常数表达式为________.
2.硫酸生产中,接触室内的反应:2SO2(g)+O2(g)![]() 2SO3(g);SO2的平衡转化率与体系总压强的关系如图所示.某温度下,将2.0 mol SO2和1.0 mol O2置于30 L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是________mol·L-1·min-1.
2SO3(g);SO2的平衡转化率与体系总压强的关系如图所示.某温度下,将2.0 mol SO2和1.0 mol O2置于30 L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是________mol·L-1·min-1.
3.下图平衡状态由A变到B时,改变的外界条件是________.
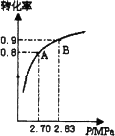
a.又加入一些催化剂
b.又加入一些氧气
c.降低了体系的温度
d.升高了外界的大气压
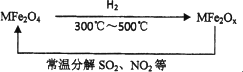
4.新型纳米材料氧缺位铁酸盐MFe2Ox在常温下,能将氮的氧化物和SO2等废气分解除去.转化流程如图所示,若x=3.5,M为Zn,请写出ZnFe2O3.5分解SO2的化学方程式________
查看答案和解析>>
科目:高中化学 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:022
在某化工生产中,要用到一种无色、可溶于水的晶体——铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.
已知NH4+与AlO2-在水溶液中不能大量共存,会发生反应:NH4++AlO2-+H2O![]() Al(OH)3↓+NH3↑.试回答:
Al(OH)3↓+NH3↑.试回答:
(1)硫酸铝铵在水溶液中的电离方程式为________;
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀 ②有刺激性气味的气体产生 ③白色沉淀量逐渐增多 ④白色沉淀完全消失 ⑤白色沉淀量逐渐减少
请答出各种现象,由先到后出现的顺序(用序号回答)________;
(3)依次写出滴入NaOH溶液的过程中有关反应的离子方程式:
①________;
②________;
③________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题: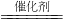 2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.
2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com