
【题目】根据题意填空
(1)在标准状况下,有物质①4gH2 , ②33.6LCH4 , ③1molH2O,④3.01×1023个O2 , 含分子数最多的是(填序号,下同) , 含原子数最少的是 , 质量最大的是 , 体积最小的;密度由大到小的顺序为: .
(2)含有相同氧原子数的CO和CO2 , 其质量比为;物质的量比为;碳原子数比为;原子数比为 .
(3)含有电子数相等的CO和CO2 气体在同温同压下的体积比为;密度比为 .
【答案】
(1)①;④;②;③;③>④>②>①
(2)14:11;2:1;2:1;4:3
(3)11:7;7:11
【解析】解:(1)在标准状况下,①4g H2的物质的量为 ![]() =2mol;原子数为2×2=4mol;体积为2×22.4=44.8L;②33.6L CH4的物质的量为
=2mol;原子数为2×2=4mol;体积为2×22.4=44.8L;②33.6L CH4的物质的量为 ![]() =1.5mol;原子数为1.5×5=7.5mol;质量为1.5×16=24g;③1mol H2O的物质的量为1mol;原子数为1×3=3mol;质量为18g;④3.01×1023个O2的物质的量为
=1.5mol;原子数为1.5×5=7.5mol;质量为1.5×16=24g;③1mol H2O的物质的量为1mol;原子数为1×3=3mol;质量为18g;④3.01×1023个O2的物质的量为 ![]() =0.5mol;原子数为0.5×2=1mol;质量为0.5×32=16g;体积为0.5×22.4=11.2L,故含分子数最多的是①;含原子数最少的是④;质量最大的是②;体积最小的是③;密度由大到小的顺序为③>④>②>①;所以答案是:①;④;②;③;③>④>②>①;(2)含有相同氧原子数的CO和CO2 , 其物质的量比为
=0.5mol;原子数为0.5×2=1mol;质量为0.5×32=16g;体积为0.5×22.4=11.2L,故含分子数最多的是①;含原子数最少的是④;质量最大的是②;体积最小的是③;密度由大到小的顺序为③>④>②>①;所以答案是:①;④;②;③;③>④>②>①;(2)含有相同氧原子数的CO和CO2 , 其物质的量比为 ![]() :
: ![]() =2:1;质量比为2×28:1×44=14:11;碳原子数之比等于2:1;原子数比为2×2:1×3=4:3,所以答案是:14:11;2:1;2:1;4:3;(3)一个CO、CO2 分子中电子数分别是14、22,含有电子数相等的CO和CO2气体,其分子个数之比为22:14=11:7,根据n=
=2:1;质量比为2×28:1×44=14:11;碳原子数之比等于2:1;原子数比为2×2:1×3=4:3,所以答案是:14:11;2:1;2:1;4:3;(3)一个CO、CO2 分子中电子数分别是14、22,含有电子数相等的CO和CO2气体,其分子个数之比为22:14=11:7,根据n= ![]() 知,二者物质的量之比为11:7,根据V=nVm得二者体积之比等于物质的量之比为11:7,根据ρ=
知,二者物质的量之比为11:7,根据V=nVm得二者体积之比等于物质的量之比为11:7,根据ρ= ![]() 知,二者密度之比等于摩尔质量之比=28g/mol:44g/mol=7:11,所以答案是:11:7;7:11.
知,二者密度之比等于摩尔质量之比=28g/mol:44g/mol=7:11,所以答案是:11:7;7:11.


科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. K2SO4=2K++SO4-2 B. Ba(OH)2=Ba2++OH2-
C. Mg(NO3)2=Mg2++2(NO3)2- D. Fe2(SO4)3=2Fe3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为a%、物质的量浓度为c1mol·L-1的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2mol·L-1。已知硫酸浓度越大,密度越大,则c1与c2的数值关系是
A. c1=2c2 B. c2=2cl C. c2>2c1 D. c2<2cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法错误的是( )
A.乙酸乙酯中含有18O
B.18O存在于水中
C.此反应属于取代反应
D.生成的乙酸乙酯的相对分子质量为90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在容积为2.0 L的密闭容器内,物质D在T℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
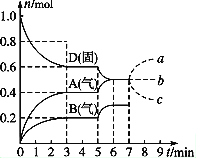
(1)从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为________________。
(2)第5 min时,升高温度,A、B、D的物质的量变化如图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(3)若在第7 min时增加D的物质的量,其他条件不变,则A的物质的量图像变化正确的是______________(用图中a、b、c的编号回答)。
II.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+ I2(g)![]() WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
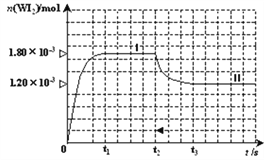
(4)该反应是__________(填写“放热”、“吸热”)反应。在450℃时,该反应的平衡常数K=________。
(5)若t2时温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量______________(填“变大”、“不变”或“变小”)。
(6)若t2时温度不变,向该容器中再加入0.002molW、0.0006molI2、0.0054mol WI2,则化学平衡________________(填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制。铝在下列场合须加以控制的是( )
①糖果内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(作内服药) ⑤用明矾和小苏打作出食物膨化剂.
A.①③④⑤B.②③④⑤C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示,根据以上微观示意图得出的结论中,正确的是( ) 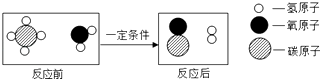
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含氢元素的化合物有3种
D.该反应的化学方程式中甲烷和水的计量数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的化学方程式或离子方程式正确的是
A. 氯气用于自来水的杀菌消毒:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 将“NO2球”浸泡在热水中,颜色变深:2NO2(g)![]() N2O4(g) △H<0
N2O4(g) △H<0
C. 向Ba(OH)2溶液中滴加NaHSO4溶液,至溶液呈中性:OH-+ Ba2++ H++SO42-== BaSO4↓+ H2O
D. 除去铁粉中的杂质Al:Al+2OH-== AlO2-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com