
【题目】下列有关实验操作与现象相匹配的是( )
选项 | 实验操作 | 现象 |
A | 将石蜡油分解得到的产物直接通入少量溴的CCl4溶液中 | 无明显现象 |
B | 将浓硫酸和蔗糖反应产生的气体通入少量的 | 气体全部被吸收且溶液紫红色变浅 |
C | 向淀粉碘化钾溶液中通入过量氯气 | 溶液先变蓝后褪色 |
D | 向 | 无沉淀生成 |
A.AB.BC.CD.D
【答案】C
【解析】
A.在催化剂作用下,石蜡油受热发生裂化反应生成气态烷烃和烯烃,烯烃能使溴的CCl4溶液褪色,故A错误;
B.浓硫酸和蔗糖反应产生的气体为二氧化碳和二氧化硫的混合气体,二氧化碳没有还原性,不能与酸性高锰酸钾溶液反应,则气体不能全部被吸收,故B错误;
C.向淀粉碘化钾溶液中通人过量氯气,碘化钾溶液与氯气发生置换反应生成单质碘,单质碘遇淀粉呈蓝色,氯气具有强氧化性,过量氯气能将单质碘氧化生成碘酸,溶液的蓝色会褪去,故C正确;
D.亚硫酸氢钠溶液中,亚硫酸氢根离子的电离程度大于水解程度,溶液呈酸性,酸性溶液中硝酸根具有强氧化性,能将亚硫酸氢根离子氧化生成硫酸根,硫酸根与钡离子反应生成硫酸钡白色沉淀,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
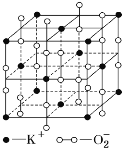
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个,晶体中与每个O2-距离最近的O2-有6个
D.晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
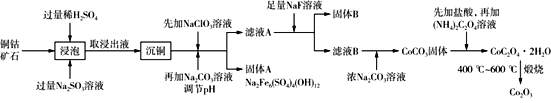
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
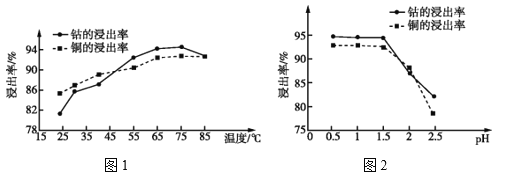
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的( )

A.人体血液的pH在7.35~7.45之间,用药后人体中含As元素的主要微粒是AsO33-
B.n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液显酸性
C.当pH调至11时发生反应的离子方程式是H3AsO3+OH-=H2AsO3-+H2O
D.pH=12时,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物。由此可知,下列说法正确的是( )
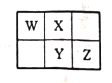
A.X形成的单核阴离子的还原性大于Y形成的单核阴离子的还原性
B.Y、Z的氧化物对应水化物的酸性一定是Y的强于Z的
C.X、Y、Z的最简单氢化物中稳定性最弱的是Y的氢化物
D.Z的单质在化学反应中只能表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以![]() 、天门冬氨酸(
、天门冬氨酸(![]() )为原料制备。回答下列问题:
)为原料制备。回答下列问题:
(1)Zn成为阳离子时首先失去______轨道电子。碲(Te)与O同主族,则Te元素中电子占据的能量最高的能级是______。
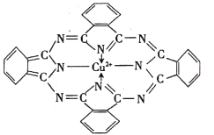
(2)P是N的同族元素,PH3与NH3中稳定性更高的是______(填化学式),其判断理由是______;酞菁铜可用于生产蓝色颜料(结构如图),其中C原子的轨道杂化类型为______。
(3)CO为______(填“极性”或“非极性”)分子。
(4)ZnO晶体的一种晶胞结构如图:
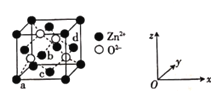
①![]() 的配位数为____________。
的配位数为____________。
②以晶胞边长为单位长度建立的坐标系可表示晶胞中锌原子的位置,称作原子分数坐标。图中原子a的分数坐标为![]() ,原子d的分数坐标为
,原子d的分数坐标为![]() ,则原子b和c的分数坐标分别为______、______。
,则原子b和c的分数坐标分别为______、______。
③设![]() 为阿伏加德罗常数的值。已知晶胞边长为
为阿伏加德罗常数的值。已知晶胞边长为![]() nm,则ZnO晶体的密度为______(列出计算式)
nm,则ZnO晶体的密度为______(列出计算式)![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成(部分反应物或产物省略,另请注意箭头的指向):
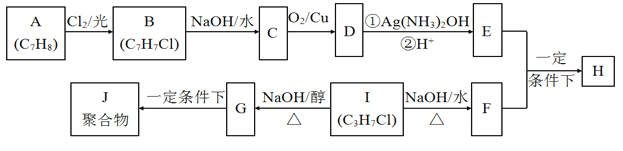
已知以下信息:
i.A属于芳香烃,H属于酯类化合物;
ii.I的核磁共振氢谱有两组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称为____________________,B的结构简式为___________________。
(2)B→C和G→J两步的反应类型____________________;_______________________。
(3)①E+F→H的化学方程式:_________________________________。
②D与银氨溶液反应的化学方程式:___________________________。
(4)I的同系物K比I相对分子质量大28,K有多种同分异构体。
①K的同分异构体共_______________种。
②若K不能发生消去反应,则K的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol·L-1一元酸HA中滴加相同浓度的KOH溶液,溶液中由水电离的氢离子浓度随加入KOH溶液体积的变化如图所示。则下列说法错误的是
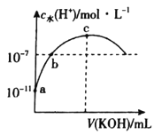
A.HA的电离常数约为10-5
B.b点溶液中存在:c(A-)=c(K+)
C.c点对应的KOH溶液的体积V=20 mL,c水(H+)约为7×10-6 mol·L-1
D.导电能力:c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇(![]() )制备乙酸正丁酯,制备过程如下:
)制备乙酸正丁酯,制备过程如下:
①在干燥的![]() 圆底烧瓶中,加入一定量的正丁醇和冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器一分水器的支管口。
圆底烧瓶中,加入一定量的正丁醇和冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器一分水器的支管口。
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
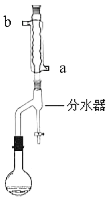
请回答有关问题:
(1)冷凝水的流向为________进________出(填a或b)。
(2)步骤②中不断从分水器下部分出生成的水的目的是________________。步骤②中判断反应终点的依据是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com