
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类不相同 | |
| C. | c(OH-)前者小于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
分析 A、任何溶液中均存在水的电离平衡,在水溶液中碳酸氢根存在电离平衡和水解平衡;
B、根据溶液中存在的微粒来回答;
C、碳酸根的水解程度大于碳酸氢根,水解规律:谁强显谁性;
D、碳酸氢根和氢氧根在溶液中不共存.
解答 解:A、Na2CO3溶液中存在水的电离平衡和碳酸根的水解平衡,NaHCO3在水溶液中存在碳酸氢根的电离平衡和水解平衡以及水的电离平衡,故A正确;
B、NaHCO3和Na2CO3溶液中存在的微粒均为:钠离子、碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故B错误;
C、碳酸根的水解程度大于碳酸氢根,二者水解均显碱性,跟据水解规律:谁强显谁性,所以碳酸钠中的氢氧根浓度大于碳酸氢钠溶液中的氢氧根浓度,所以c(OH-)前者小于后者,故C正确;
D、分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大,故D正确.
故选:B.
点评 本题考查学生盐的水解原理的应用知识,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
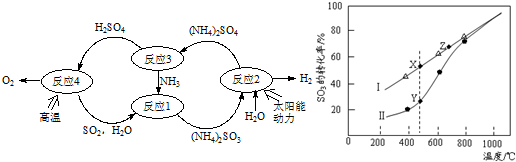
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
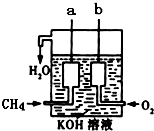 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7个 | B. | 8个 | C. | 9个 | D. | 10个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
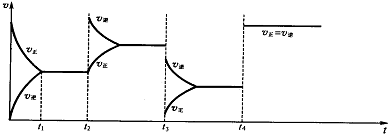
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 164.1 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com