
| A. | 尼龙 | B. | 黏胶纤维 | C. | 硝化纤维 | D. | 醋酸纤维 |
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成a mol A的同时消耗2a mol C | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | B气体的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
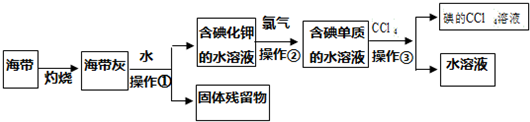
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 中性溶液中:Fe3+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中:Na+、ClO-、SO42-、I- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
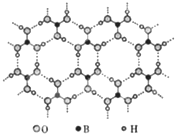 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com