
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
科目:高中化学 来源: 题型:多选题
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
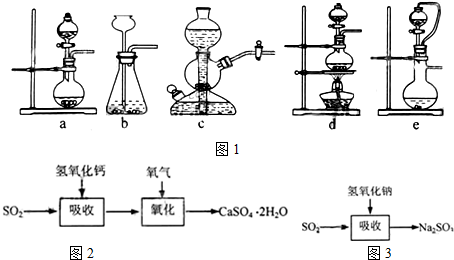
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水与液氯净水的原理相同 | |
| B. | 将草木灰和硫铵混合施用,肥效更高 | |
| C. | 冬季形成的大雾属于气溶胶 | |
| D. | 电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
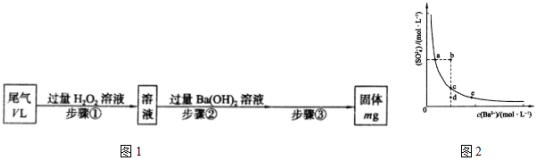
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
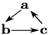 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com