
【题目】乙醇(CH3CH2OH)是一种重要的有机物
(1)根据乙醇分子式和可能结构推测,1mol乙醇与足量钠反应,产生氢气的物质的量可能是________________mol。
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,该反应的化学方程式是________________________________,乙醇的官能团是_______________。
(3)用如图装置实验,干冷烧杯罩在火焰上,有无色液体产生。

能否据此说明一定有氢气产生,判断及简述理由是_________________________。
(4)乙醇与钠反应比水与钠反应平缓的多,原因是_______________________________ 。
【答案】0.5、2.5、3 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 羟基 不能,因为氢气中会含有乙醇蒸汽 乙醇分子中羟基上的氢原子没有水中氢原子活泼
【解析】
由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;乙醇的结构中含有官能团-羟基,能够与金属钠反应置换出氢气,且羟基中氢原子的活泼性小于水中氢原子活泼性,乙醇和钠反应与钠与水比较要缓慢的多,据以上分析解答。
(1)由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,说明钠与乙醇反应置换的是羟基上的氢原子,化学方程式为2C2H5OH+2Na→2C2H5ONa+H2↑;乙醇的官能团为羟基;
(3) 图示实验装置不能说明一定有氢气产生,因为乙醇易挥发,乙醇、氢气燃烧都能生成水;
(4) 乙醇分子中羟基上的氢原子没有水中氢原子活泼,乙醇与钠反应比水与钠反应平缓的多。


科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
A.单位时间内生成n molO2的同时,生成2nmolNO
B.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C.混合气体的质量不再改变的状态
D.混合气体的平均相对分子质量不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
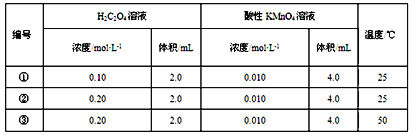
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1molH2C2O4转移___mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥___。
(2)探究温度对化学反应速率影响的实验编号是___(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____。
II.水煤气变换CO(g) + H2O(g)![]() CO2(g) + H2(g)是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。已知T(大于100)℃时,将2molCO(g)和3molH2O(g)通入一容积固定为2L的密闭容器中,回答下列问题:
CO2(g) + H2(g)是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。已知T(大于100)℃时,将2molCO(g)和3molH2O(g)通入一容积固定为2L的密闭容器中,回答下列问题:
(1)反应进行到1min时测得CO的物质的量为1.8mol,则H2的平均反应速率为___,此时改变某一条件,能使H2的平均反应速率加快的是___。
A.恒容时充入氖气 B.升高温度 C.将体积缩小一半 D.恒温恒容,移走CO2
(2)已知在T℃时H2(g)+CoO(s)![]() Co(s)+H2O(g) K1=1,CO(g)+CoO(s)
Co(s)+H2O(g) K1=1,CO(g)+CoO(s)![]() Co(s)+CO2(g) K2=4,求T℃时,CO(g)+H2O(g)
Co(s)+CO2(g) K2=4,求T℃时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为___。
CO2(g)+H2(g)的平衡常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1909年德国化学家哈伯在实验室首次合成氨,合成氨技术的创立开辟了人工固氮的重要途径,其研究正是基于科学化学反应原理的指导。
(1)已知298K时,N2(g)+3H2(g)![]() 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3
则ΔH3=___kJ/mol。
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4____。
②下列时间段中,氨的百分含量最高的是____。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。

①N2、H2的投料比为____。
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为___(可用分数表示)。
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取少量溴苯。

请回答下列问题:
(1)在烧瓶a中反应的化学方程式是__________________________________________。
(2)与烧瓶口垂直的一段长导管的作用是______________________________________。
(3)锥形瓶C中盛放四氯化碳的作用是________________________________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入硝酸银溶液,若________,则能证明。另一种验证的方法是向锥形瓶C中加入________________________,现象是________________________________________________________________________。
(5)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是____________________________。
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是_________________________,反应的化学方程式是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com