
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是
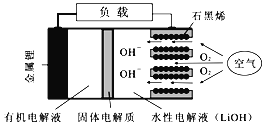
A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. Li+穿过固体电解质向正极移动而得到LiOH溶液
D. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
【答案】C
【解析】A项,放电时,锂为负极,负极反应式为Li-e-=Li+,错误;B项,石墨烯为正极,正极电极反应式为O2+4e-+2H2O=4OH-,当外电路中有1mol电子转移时,正极生成1molOH-,同时有1molLi+通过固体电解质流向水性电解液,水性电解液离子总数增加2mol,即增加2NA,错误;C项,固体电解质只允许Li+通过,Li+穿过固体电解质向正极移动而得到LiOH溶液,正确;D项,电镀铜阴极电极反应式为Cu2++2e-=Cu,n(Cu)=![]() =1mol,电路中通过电子物质的量为2mol,根据正极反应式O2+4e-+2H2O=4OH-,正极消耗O2物质的量为0.5mol,由于O2所处温度压强未知,无法计算消耗O2的体积,错误;答案选C。
=1mol,电路中通过电子物质的量为2mol,根据正极反应式O2+4e-+2H2O=4OH-,正极消耗O2物质的量为0.5mol,由于O2所处温度压强未知,无法计算消耗O2的体积,错误;答案选C。


科目:高中化学 来源: 题型:
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A.3.6mol/L
B.3.2mol/L
C.2.8mol/L
D.2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应
CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应
速率几乎无影响的是
A. 增加CO的量
B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大
D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纺织品上的矿物油可以用烧碱溶液清洗
B.用钢瓶储存液氯或浓硫酸
C.在船身上装锌块是使用了外加电流的阴极保护法
D.葡萄糖溶液和淀粉溶液都可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( ) 
A.简单离子的半径:X<Z<M
B.最高价氧化物对应水化物的酸性:R<N
C.Y、R两种元素的气态氢化物稳定性:Y>R
D.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( ) 
A.锌是负极,电子从锌片经导线流向铜片
B.氢离子在铜片表面被还原
C.如果将硫酸换成橙汁,导线中不会有电子流动
D.装置中存在“化学能→电能→光能”的转换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
B. 升高温度,正向反应速率增加,逆向反应速率减小
C. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com