
 按要求完成下列各题:
按要求完成下列各题:分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物•较活泼金属氧化物•SiO2•H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)四氯化硅和氮气、氢气反应生成氮化硅和氯化氢;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅;
(4)明矾水解生成具有吸附性的氢氧化铝胶体;
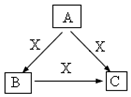
(5)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠,由此分析解答;
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,
则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,
[Al2Si2O5(OH)4]可改成Al2O3•2SiO2•2H2O,
故答案为:Al2O3•2SiO2•2H2O;
(2)四氯化硅和氮气、氢气反应生成氮化硅和氯化氢,化学方程式为3SiCl4+2N2+6H2═Si3N4+12HCl;
故答案为:3SiCl4+2N2+6H2═Si3N4+12HCl;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)明矾水解生成具有吸附性的氢氧化铝胶体,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+,所以明矾净水是因为:明矾溶于水产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体有较大的吸附面积,可以吸附水中悬浮的杂质,使杂质沉降,故答案为:明矾溶于水产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体有较大的吸附面积,可以吸附水中悬浮的杂质,使杂质沉降;
(5)①氢氧化铝的制备是用铝离子与一水合氨反应制得,离子方程式为:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+,故答案为:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+;
②铝离子和偏铝酸根离子发生双水解,反应的离子方程式为:6H2O+Al3++3AlO2-=4Al(OH)3↓,故答案为:6H2O+Al3++3AlO2-=4Al(OH)3↓.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写,明确物质的性质是解本题关键,根据反应物、生成物及反应条件书写方程式,题目难度不大,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
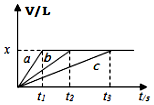 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com