
【题目】短周期元素A、B、D、E、G、J在周期表中的位置如下:
A | |||||||
B | D | ||||||
E | G | J |
根据上表回答问题:
(1)![]() 在周期表中的位置是______,D的原子结构示意图_____。
在周期表中的位置是______,D的原子结构示意图_____。
(2)![]() 、B、E、G的原子半径由大到小的顺序是_____
、B、E、G的原子半径由大到小的顺序是_____![]() 填元素符号
填元素符号![]() 。
。
(3)![]() 、D的气态氢化物的稳定性关系为______
、D的气态氢化物的稳定性关系为______![]() 填化学式
填化学式![]() ,它们都属于______
,它们都属于______![]() 离子化合物或共价化合物
离子化合物或共价化合物![]() 。
。
(4)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式________________。
【答案】第3周期第VIIA族 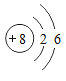 Na>Al>N>H NH3<H2O 共价化合物 Al(OH)3+NaOH=NaAlO2+2H2O
Na>Al>N>H NH3<H2O 共价化合物 Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
由短周期元素A、B、D、E、G、J在周期表中的位置可知,A为H元素、B为N元素、D为O元素、E为Na元素、G为Al元素、J为Cl元素。
(1)J为Cl元素,位于元素周期表第三周期VIIA族,D为O元素,核电荷数为8,有两个电子层,最外层的电子数为6,原子结构示意图为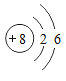 ;
;
(2)A为H元素、B为N元素、E为Na元素、G为Al元素,电子层数越大,主族元素的原子半径越大,同周期元素自左而右,原子半径依次减小,则原子半径由大到小的顺序是Na>Al>N>H;
(3)![]() 、D的气态氢化物分别为NH3、H2O,都是只含有共价键的共价化合物,同周期元素自左而右,元素非金属性依次增强,元素非金属性越强,简单氢化物的热稳定性越强,氧元素的非金属性强于氮元素,则N、O的气态氢化物的稳定性关系为NH3<H2O;
、D的气态氢化物分别为NH3、H2O,都是只含有共价键的共价化合物,同周期元素自左而右,元素非金属性依次增强,元素非金属性越强,简单氢化物的热稳定性越强,氧元素的非金属性强于氮元素,则N、O的气态氢化物的稳定性关系为NH3<H2O;
(4)氢氧化铝是两性氢氧化物,既能与强酸反应又能与强碱反应,氢氧化铝跟氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
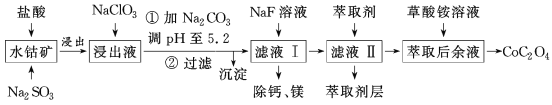
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述错误的是( )

A.H3BO3在水溶液中发生H3BO3+H2O![]() H++[B(OH4)],可知H3BO3是一元弱酸
H++[B(OH4)],可知H3BO3是一元弱酸
B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子
C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,lmolNH4BF4含有配位键的数目为NA
D.由B2O3可制备晶体硼,晶体硼的熔点2573K,沸点2823K,硬度大,属于共价晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
②Fe与稀硫酸反应制取H2时,改用98%浓硫酸
③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液
④在K2SO4与BaCl2两溶液反应时,增大压强
⑤2SO2+O2![]() 2SO3 ΔH<0,升高温度
2SO3 ΔH<0,升高温度
⑥Na与水反应时,增大水的用量
⑦2H2O2==2H2O+O2↑反应中,加入少量MnO2
⑧H2与Cl2混合后,光照
A.①②③④⑤B.①③④⑤⑥C.①③⑤⑦⑧D.①③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru配合物与g—C3N4复合光催化剂将CO2还原为HCOOH的原理示意图如图。
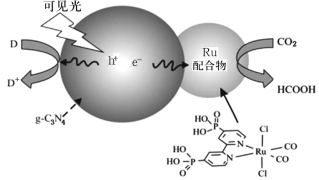
(1)Ru基态原子价电子排布式为4d75s1,写出该元素在元素周期表中的位置___,属于___区。
(2)HCOOH中σ键与π键的数目之比是___,HCOOH的沸点比CO2高的原因___。
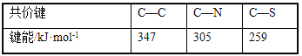
(3)紫外光的光子所具有的能量约为399kJ·mol1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因__。
(4)已知![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
(5)下列状态的氮、氧原子中,电离最外层一个电子所需能量最大的是___(填序号,下同),最小的是___(填序号)。
A.氮![]()
B.氧![]()
C.氧![]()
D.氧![]()
(6)一种类石墨的聚合物半导体g—C3N4,其单层平面结构如图1,晶胞结构如图2。
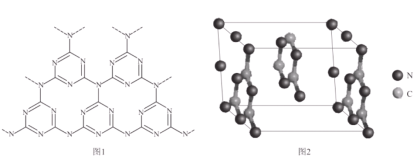
①g—C3N4中氮原子的杂化类型是__;
②根据图2,在图1中用平行四边形画出一个最小重复单元___;
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部,设阿伏加德罗常数的值为NA,则g—C3N4的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用![]() 溶液以恒定速度来滴定,根据测定结果绘制出
溶液以恒定速度来滴定,根据测定结果绘制出![]() 、
、![]() 等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
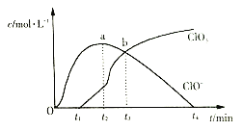
A.![]() 溶液和浓氯水可以使用同种滴定管盛装
溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:![]()
C.b点溶液中各离子浓度:![]()
D.![]() ,
,![]() 生成速率越来越快
生成速率越来越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物在生产生活中有着广泛的用途。如图为合成高分子化合物G的流程。

已知:①![]() →
→![]()
②![]()
![]()
![]()
请回答下列问题:
(1)A物质为烃,则A的名称为_________,物质E含有的官能团名称是_________。
(2)由C生成D的反应类型是____________。
(3)由B生成C的化学反应方程式为_________。
(4)F的结构简式为___________。
(5)M是D的同分异构体,M满足以下条件:苯环上取代基的数目不少于两个,且能够与NaHCO3反应放出CO2,共有_______种。其中核磁共振H谱为4组峰,其峰面积比为6:2:1:1的结构简式为_______。
(6)根据题中信息和有关知识,以2-丙醇为原料,选用必要的无机试剂,合成![]() ,写出合成路线 __________。
,写出合成路线 __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com