
【题目】港珠澳大桥的建造使用了大量钢材.对钢铁采取的防腐措施合理的是( )
A. 表面镶铜 B. 表面喷涂油漆
C. 用水清洗 D. 增加钢铁中的碳含量
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下。下列说法正确的是( )

A. 对苯二酚能与4mol Br2反应
B. 1 mol该中间体最多可与12 mol H2反应
C. 2,5-二羟基苯乙酮能发生加成、取代、消去反应
D. 1mol该中间体分子最多可以消耗7 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ/mol;
2CO2(g) ΔH=566 kJ/mol;
②Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ/mol
O2(g) ΔH=226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)![]() 2Na2CO3(s)+O2(g) ΔH>452 kJ/mol
2Na2CO3(s)+O2(g) ΔH>452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ 热量时,转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
![]()

已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。

回答下列问题:
(1)由A生成B的反应类型________________
(2)C的结构简式为______,其核磁共振氢谱显示为_______组峰,C的二氯代物有______种。
(3)由D生成E的反应条件为_________________
(4)G的聚合物在酸性条件下水解的化学方程式 _________________________________
(5)D中的官能团有______、______、______(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较电离度大小:(填“>”或“<”)
①20℃时,0.01 mol·L-1HCN溶液_______40℃时0.01 mol·L-1HCN溶液。
②10℃时0.01 mol·L-1CH3COOH溶液_______10℃时0.1 mol·L-1CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取气体的装置如下图所示,根据所学知识,回答下列问题:

(1)图中标有①②的仪器名称:①_____________;②___________。
(2)写出一个用装置A制取氧气的化学方程式_______________________________。
(3)实验室用石灰石和稀盐酸反应制取二氧化碳时,应选用图中_________和______ 来组装一套实验装置,检验二氧化碳集满的方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2FeCl3+2KI![]() 2FeCl2+2KCl+I2 ②KClO3+6HCl
2FeCl2+2KCl+I2 ②KClO3+6HCl![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
③2FeCl2+Cl2![]() 2FeCl3 ,下列物质的氧化能力强弱顺序正确的是
2FeCl3 ,下列物质的氧化能力强弱顺序正确的是
A.FeCl3>Cl2>I2> KClO3 B.KClO3>Cl2> FeCl3>I2
C.Cl2>KClO3> FeCl3>I2 D.KClO3>Cl2>I2> FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.0 g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气8.96 L,则混合物中Fe与Al的物质的量之比( )
A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种常见的滴定剂和重要化工原料。实验室制备硫代硫酸钠的流程如下:

回答下列问题:
(1)“溶解”使用的水必须先煮沸一段时间,然后冷却至室温待用。其目的是____________。
(2)“反应”中的化学方程式为_____________________________________________。
(3)设计如图所示装置制备硫代硫酸钠晶体:
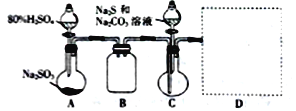
①B瓶的作用是___________________。
②实验中先打开________(填“A”或“C”)处分液漏斗的活塞。.
③装置D用于处理尾气,可选用的最合理装置为______________(填标号)。

(4)为了探究粗产品中的杂质,进行如下假设并进行实验:
①该粗产品中可能含有的杂质是Na2CO3、NaHCO3、Na2SO3、NaHSO3、S、Na2S和_____________
等其中的一种或几种。
②取少量产品于试管,加入足量稀硫酸,将气体通入CuSO4溶液中,未产生黑色沉淀。据此,______(填“能”,或“不能”)认为粗产品中一定没有Na2S,理由是 _____________________________。
③请选择下列试剂设计实验方案,检验产品中含有Na2CO3或NaHCO3。
限选试剂:3 molL-1H2SO4溶液、1 mol L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水。
实验方案 | _______. |
实验现象 | _______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com