
【题目】德裔美籍固体物理学家古迪纳夫在研究钴酸锂LiCOO3)。磷酸亚铁锂(LiFePO4)等正极材料及锂离子电池领域作出卓著贡献而获得2019年诺贝尔化学奖,其中磷酸亚铁锂(LiFePO4)是一种新型汽车理离子电池,总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
A.充电时,铁元素发生还原反应
B.放电时,Li作负极
C.放电时,正极反应为FePO4+Li++e-=LiFePO4
D.若用该电池电解饱和食盐水(电解池电极均为情性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4g
【答案】A
【解析】
A.根据总反应可知,充电时Fe元素由+2价变为+3价,失电子化合价升高,发生氧化反应,A错误;
B.由放电时原电池原理知,负极反应为Li 失电子(Li-e-=Li+) 发生氧化反应,B正确;
C.放电时,FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为FePO4+Li++e-=LiFePO4,C正确;
D.电解饱和食盐水时阳极产生氯气,阴极产生氢气,且体积比为1:1,当电解池两极共有4480mL气体(标准状况)产生时,气体物质的量为0.2mol,则生成氢气物质的量0.1mol,转移的电子为0.2mol,根据电子守恒可知消耗的Li为0.2mol,消耗锂的质量为0.2mol×7g/mol=1.4g,D正确;
故答案为A。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,试回答(硝酸银足量):
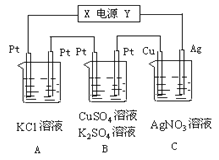
(1)电源电极X名称为____。
(2)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为____。
(3)若A中KCl溶液的体积也是200mL(KCl足量,不考虑氯气的溶解),电解后溶液的c(OH-) =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
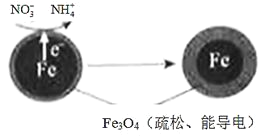
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.在10mL2.4mol·L-1的NaOH溶液中加入50mL水,稀释后溶液的浓度是0.4mol·L-1
B.从1L2mol·L-1的H2SO4溶液中取出0.5L,所得溶液的浓度为1mol·L-1
C.配制500mL0.5mol·L-1的CuSO4溶液,需62.5g胆矾
D.中和100g19.6%的H2SO4溶液,需要NaOH4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
![]() 铝的基态原子的价电子排布式是_________________。
铝的基态原子的价电子排布式是_________________。
![]() 用水解法制备一种磁性材料铁氧体时常加入尿素
用水解法制备一种磁性材料铁氧体时常加入尿素![]() 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中![]() 键和
键和![]() 键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
![]() 、
、![]() 等金属离子与
等金属离子与![]() 、
、![]() 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,其原因是__________;已知氨
,其原因是__________;已知氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,联氨
,联氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,解释其熔沸点高低的主要原因:______________。
,解释其熔沸点高低的主要原因:______________。
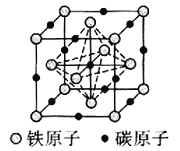
![]() 碳溶解在
碳溶解在![]() 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为![]() ,则晶胞中最近的两个碳原子的距离为__________
,则晶胞中最近的两个碳原子的距离为__________![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在学校科技节活动中表演了“滴水生火”、“吹气生火”的小魔术。如图所示,在蒸发皿上放一小团脱脂棉,在里面裹入一种淡黄色的化合物,对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉会燃烧起来。
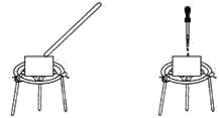
(1)淡黄色的化合物为___。
(2)由“滴水生火”的小魔术可以得出Na2O2和H2O发生反应的依据:a.有氧气生成;b.__。该反应的化学方程式是___。
(3)“吹气生火”的过程中发生的化学反应方程式为__,用双线桥标出反应中电子转移的方向和数目:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
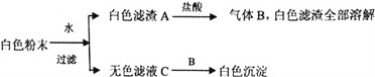
A.BaCl2、CaCO3一定存在,NaOH可能存在
B.K2SO4、CuSO4一定不存在
C.K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D.C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com