
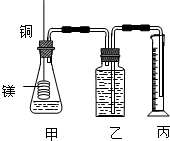
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
| A、金刚石和石墨互为同素异形体 | ||||
| B、1H、2H和3H互为同位素 | ||||
| C、18O和16O是两种不同的核素 | ||||
D、氡的放射性同位素
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2C2O4在反应中被还原 |
| B、ClO2是氧化产物 |
| C、KClO3 在反应中得到电子 |
| D、1 mol KClO3 参加反应有 2 mol 电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 |
| B、用萃取的方法分离汽油和煤油 |
| C、用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com